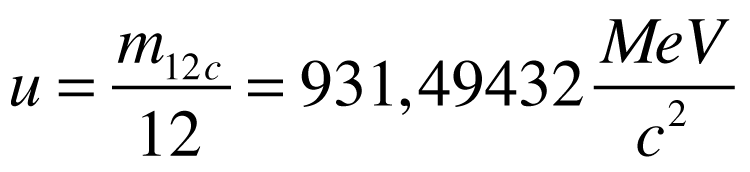Introdução
O estudo detalhado da física nuclear é complexo e demanda muito tempo.
No entanto, do ponto de vista de geração de energia, podemos trabalhar com modelos simplificados para compreender o funcionamento dos reatores nucleares.
O modelo conhecido do átomo é um núcleo denso polarizado positivamente - protóns e néutrons, orbitado por cargas polarizadas negativamente - os elétrons.
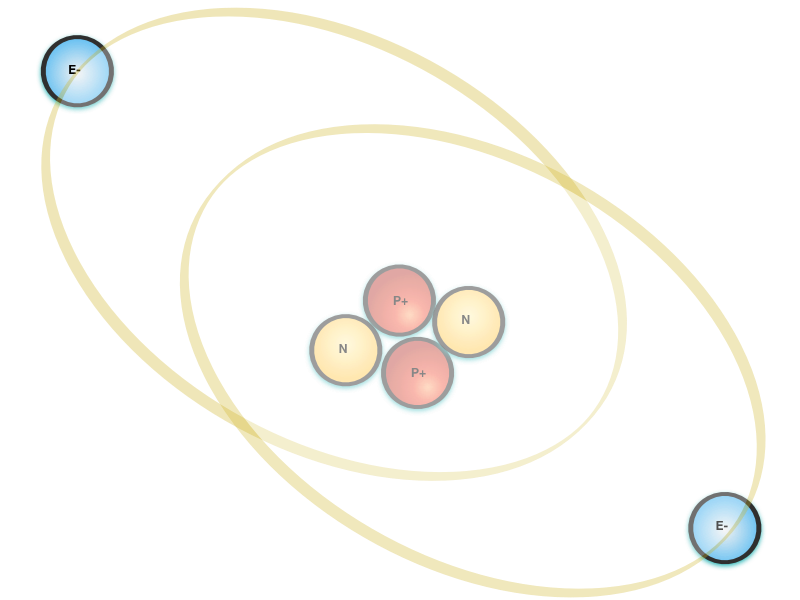
Conforme mostra a figura abaixo, o diâmetro do núcleo é da ordem de 1 pm e o diâmetro do átomo é da ordem de 100 pm.
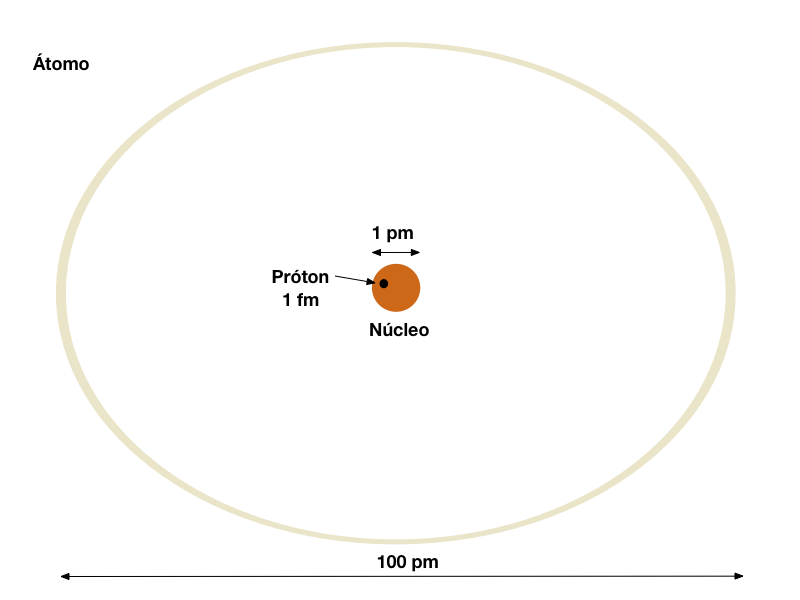
A nuvem de elétrons forma uma barreira elétrica que dificulta tremendamente a aproximação de cargas eletricamente carregadas no núcleo.
O núcleo dos átomos é formado por núcleons - Z prótons e N néutrons.
O número de prótons Z é também chamado de número atômico e define suas propriedades químicas e o número de nucleons - A - determina a massa atômica.
A figura abaixo apresenta a forma normalmente utilizada para representar os elementos nas equações de reações nucleares. É importante observar que a posição relativa da massa atômica e do número atômico podem variar dependendo da origem do autor. Contudo, como a massa atômica é sempre maior ou igual ao número atômico, é fácil verificar a referência utilizada.
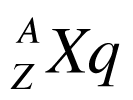
Onde:
- Z é o número de prótons ou número atômico;
- A é a massa atômica, que é igual à soma do número de protons e néutrons do átomo.
Núcleos com o mesmo número atômico mas massa atômica diferente são chamados de isótopos. Eles possuem as mesmas propriedades químicas mas o peso é diferente devido ao número de néutrons diferentes.
Reações Nucleares
A reação nuclear pode ser escrita da seguinte maneira:
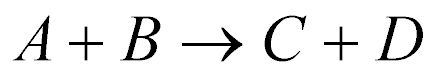
ou da seguinte maneira:
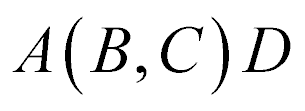
Os núcleons com menor número atômico normalmente aparecem entre os parênteses.
Exemplo:
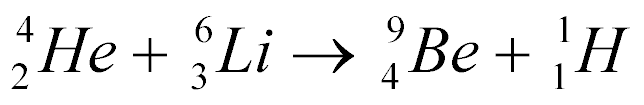
Esta equação não explica como ela acontece, não explica se libera ou absorve energia mas obedece às seguintes leis; conservação da carga e conservação de núcleons.
Estes princípios estabelecem que a quantidade de cargas e de núcleons devem permanecer constantes apesar da reação.
Isto significa que o somatório dos índices subescritos e dos sobreescritos devem ser iguais nos dois lados da equação.
Radioatividade
A radioatividade é o resultado do decaimento radioativo de núcleos instáveis.
Como não se sabe ainda como estas reações são originadas, o comportamento dos elementos radioativos é descrito de forma estatística.
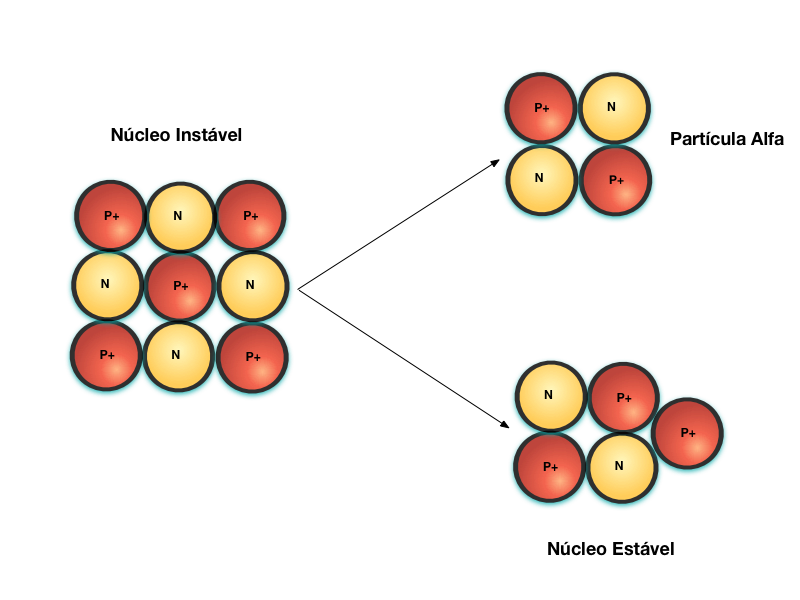
A figura abaixo apresenta o decaimento radioativo através da emissão de partículas alfa - Decaimento Alfa, que não passa do núcleo de um átomo de Hélio.
Neste caso, o núcleo original era muito grande e as forças nucleares foram insuficientes para vencer a repulsão eletromagnética. Por isso, este decaimento ocorre apenas em Isótopos de massa atômica elevada, normalmente maior que 50.
Parte do núcleo se desprende na forma de partícula alfa e um novo elemento é formado com massa atômica menor.
Como a partícula alfa é a maior, mais pesada e eletricamente carregada, seu poder de penetração na máteria é o menor de todas as formas de radioatividade porque ela é rapidamente absorvida pela matéria que estiver em seu caminho.
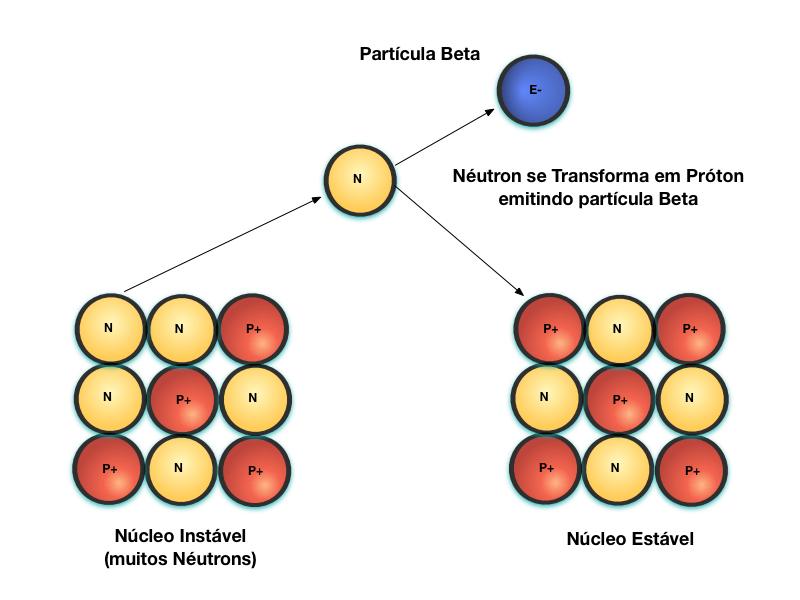
A figura abaixo mostra o processo de emissão de partículas Beta, denominado de decaimento Beta-.
Núcleos instáveis, devido ao número excessivo de néutrons, estabilizam-se através da transformação do Néutron em Próton e, em função disso, emite uma partícula Beta para manter o balaço de cargas elétricas.
Por serem mais leves do que as partículas Alfa, as partículas Beta possuem um poder de penetração maior. Contudo, como são elétricamente carregadas elas são rapidamente absorvidas ou desviadas pela matéria que estiver em seu caminho.
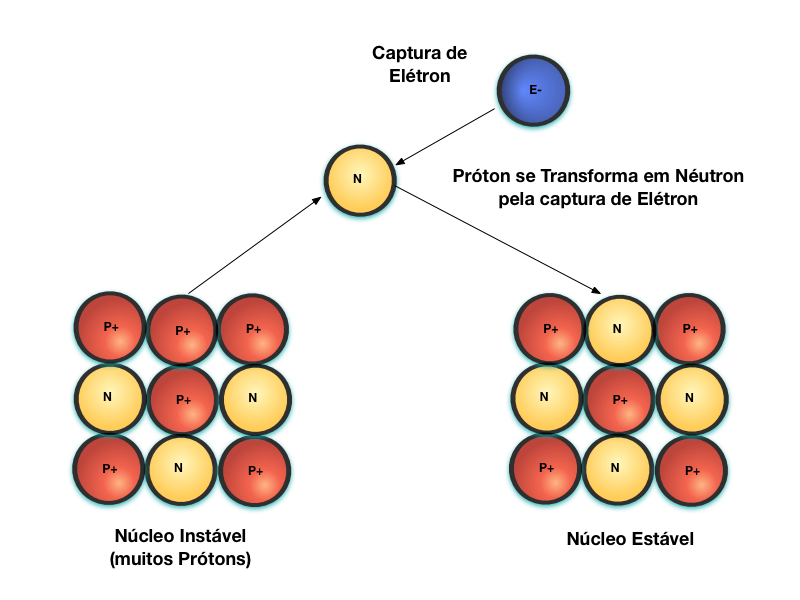
A figura abaixo mostra o decaimento Captura de Elétron. Quando um núcleo é instável devido a uma maior quantidade relativa de Prótons com relação aos Néutrons, ele pode capturar um Elétron. Quando isto ocorre, o Próton é transformado em Néutron.
Neste caso, como se trata de um processo de captura de um eletrón livre, este processo sozinho não afeta a matéria nas próximidades da reação.
Outra forma de transformar o Próton em Néutron é através do Decaimento Beta+. Neste caso, o Próton se transforma em Néutron através da emissão de um Pósitron, que é semelhante a um Elétron com carga positiva. Esta partícula possui um poder de penetração semelhante ao da partícula Beta.
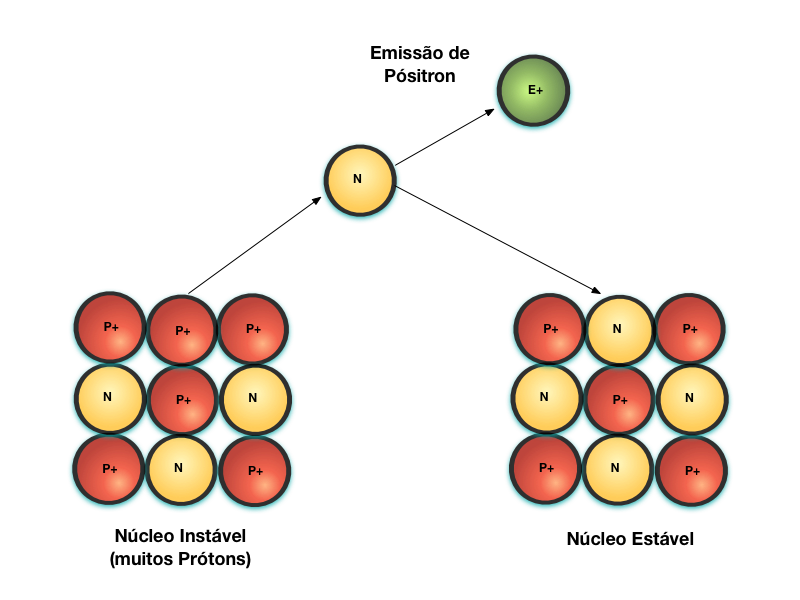
Finalmente, a figura abaixo mostra o decaimento radioativo através da emissão de energia eletromagnética na forma de raios gama. Por se tratar de um Fóton de alta energia, a radiação gama é a mais penetrante e perigosa de todas.
As reações nucleares ocorrem normalmente em mais de um estágio. Inicialmente, um núcleo instável é gerado e posteriormente se divide em dois componentes.
Dependendo do que queremos estudar, o estágio intermediário pode ser desprezado, a menos que o tempo de desintegração seja significante.
Por exemplo, a captura de um néutron pelo Índio 116 gera o Índio-117 e a emissão de raio gama, conforme a equação abaixo:

Como Índio-117 não é estável, ele decai da seguinte maneira:
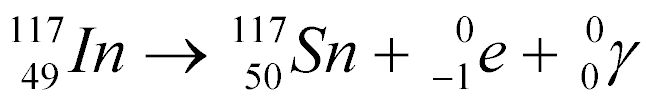
O decaimento de isótopos necessita de um determinado tempo para se completar e este tempo depende do isótopo em questão. Este tempo pode variar de milisegundos a anos.
Por isso, a meia vida de determinado isótopo é definida como sendo o tempo necessário para que metade dos núcleons originais decaia.
Os raios gama são algumas vez omitidos das reações nucleares porque não afetam o balanço de cargas nem de núcleons. Isto ocorre, porque eles não possuem massa nem carga. No entanto, eles precisam ser considerados no balanço de energia.
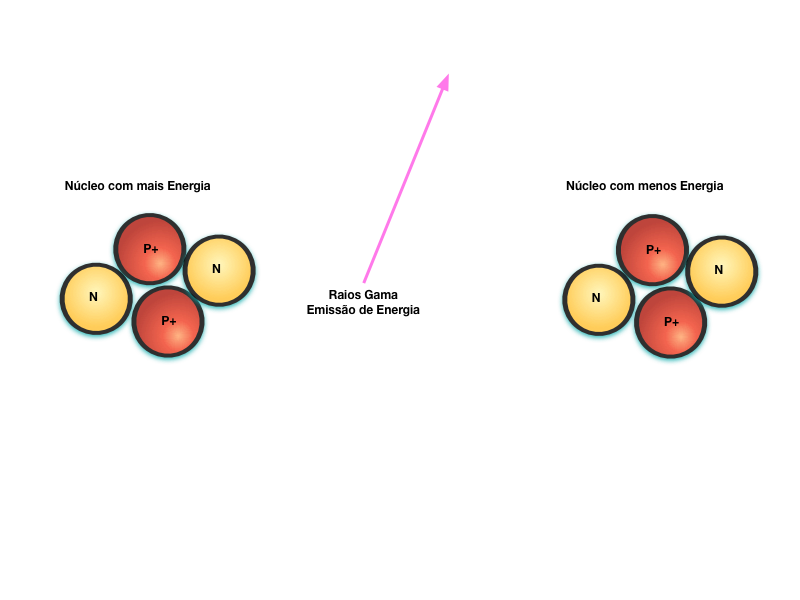
Após uma colisão nuclear, reação ou decaimento, o núcleo fica excitado. Quando ele relaxa e vai para um estado não excitado, ele emite raios gama. Os raios emitidos possuem energia proporcional à diferença dos níveis quânticos de energia do núcleo excitado e estável.
Este fenômeno equivale à emissão de fótons originada pela mudança de nível de energia dos elétrons que orbitam o núcleo.
A maior diferença entre eles é a quantidade de energia envolvida. A energia relacionada à emissão de fótons é da ordem de eV enquanto a associada aos raios gama é da ordem de MeV.
Resumindo, temos que:
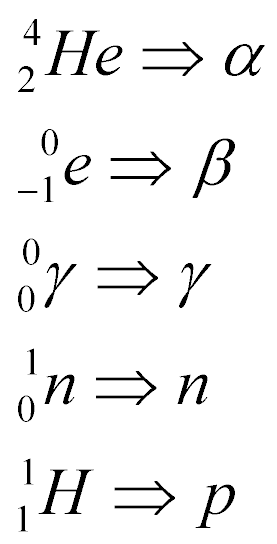
Energia
A equação de Einstein é fundamental para o cálculo do balanço de energia de reações nucleares.
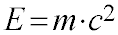
Onde:
- E é a energia total do núcleo;
- m é a massa do núcleo;
- c é a velocidade da luz.
No entanto, a massa utilizada nesta expressão precisa levar em consideração a velocidade relativística das partículas de acordo com:
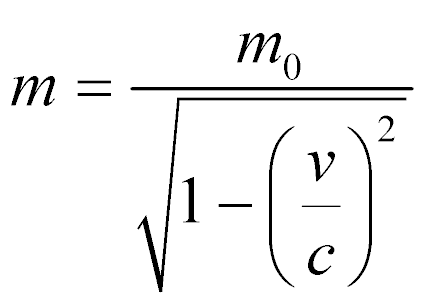
Onde:
- m0 é a massa da partícula em repouso;
- v é a velocidade da partícula.
Para velocidades menores do que a velocidade da luz, a energia total pode ser aproximada por:
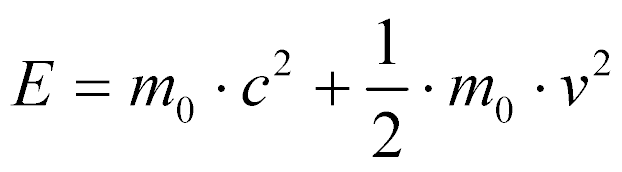
Esta aproximação pode ser utilizada para neutrons e núcleons utilizados em reatores nucleares.
A primeira parcela representa a energia em repouso e a segunda a energia cinética.
No caso de partículas sem massa, como os raios gama, a energia será dada por:
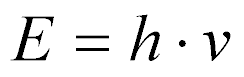
onde:
- h é a constante de Plank;
- v é a frequência.
Portanto, a lei de conservação de energia pode ser escrita para a a reação nuclear genérica da seguinte maneira:
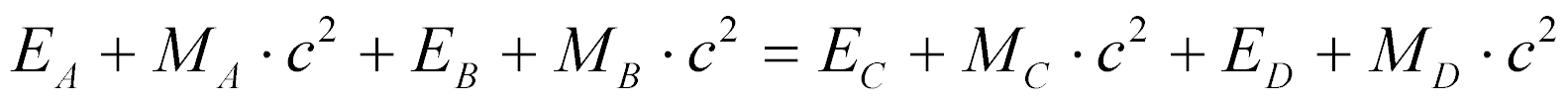
O balanço de energia da reação é dado por:
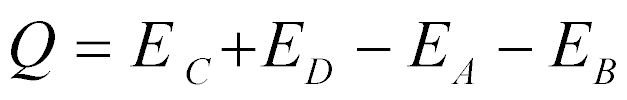
Quando Q é maior do que zero, a reação é exotérmica e, quando menor do que zero, é endotérmica.
Quando a reação é exotérmica, massa é transformada em energia cinética.
Quando a reação é endotérmica, ocorre o oposto.
Do ponto de vista de geração de energia, estamos interessados nas reações exotérmicas.
Defeito de Massa
Defeito de massa é a diferença de massa existente entre determinado átomo e o somatório das massas dos seus núcleons., conforme a expressão abaixo:
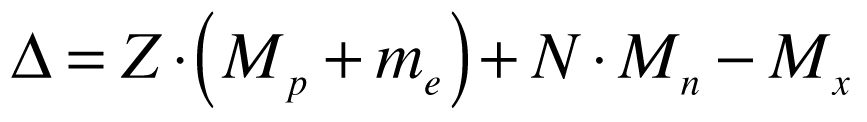
Onde:
- Δ é o defeito de massa;
- Z é o número de Prótons no núcleo;
- N é o número de Néutrons;
- Mp é a massa do Próton;
- me é a massa do Elétron;
- Mn é a massa do Néutron livre;
- Mx é a massa do núcleo do isótopo.
De acordo com Povh, a massa do núcleo do isótopo pode ser aproximada por:
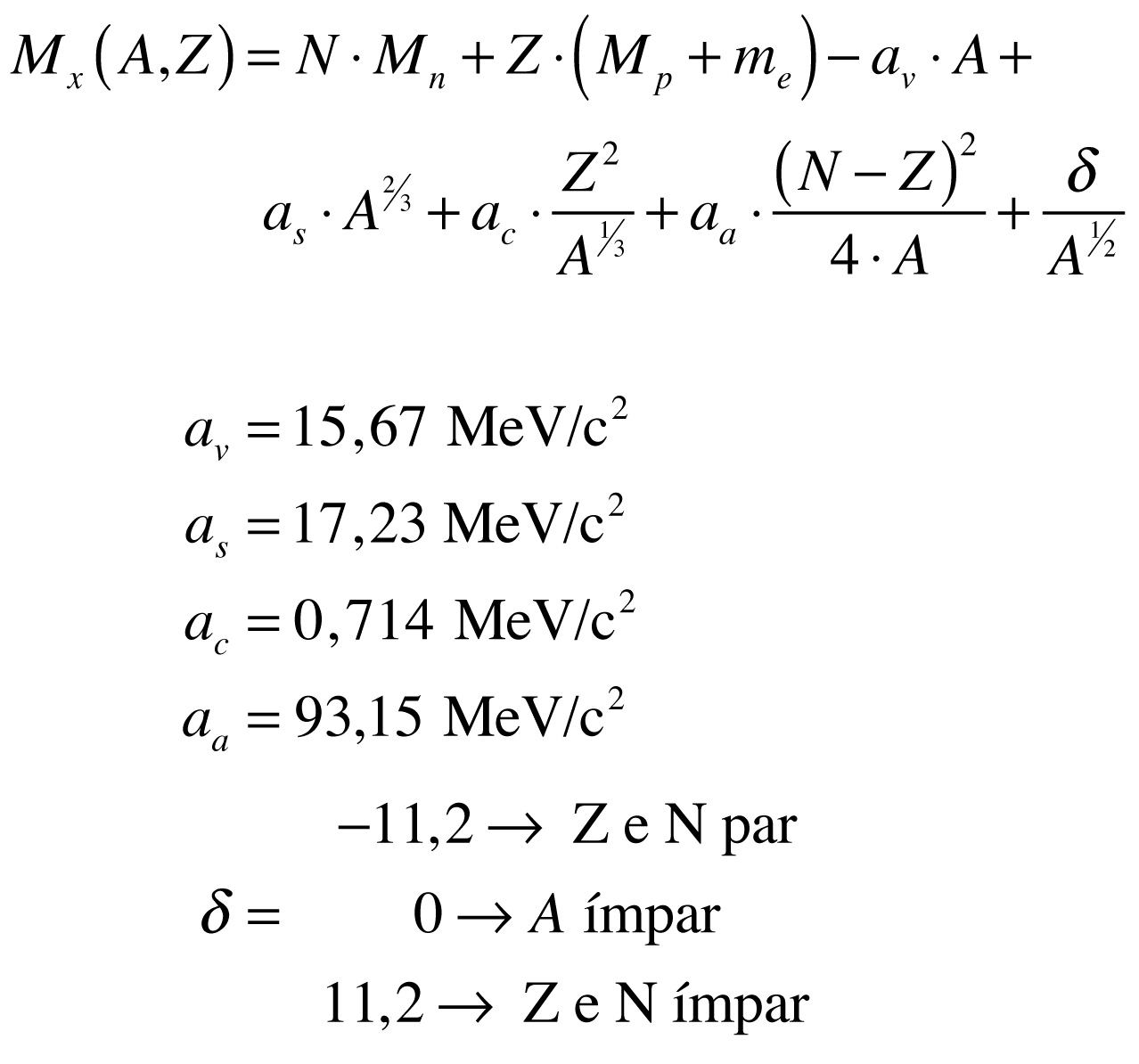
O defeito de massa é sempre positivo para todos os elementos.
O defeito de massa multiplicado pela velocidade da luz ao quadrado fornece o valor da Energia de Ligação do núcleo (El=Δ.c²).
Quanto maior esta energia, mais estável é o núcleo. Portanto, a energia de ligação representa a energia necessária para separar totalmente os núcleons de determinado núcleo.
A energia de ligação pode ser normalizada pelo número de núcleons da seguinte maneira:
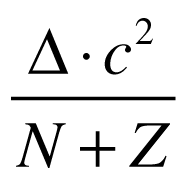
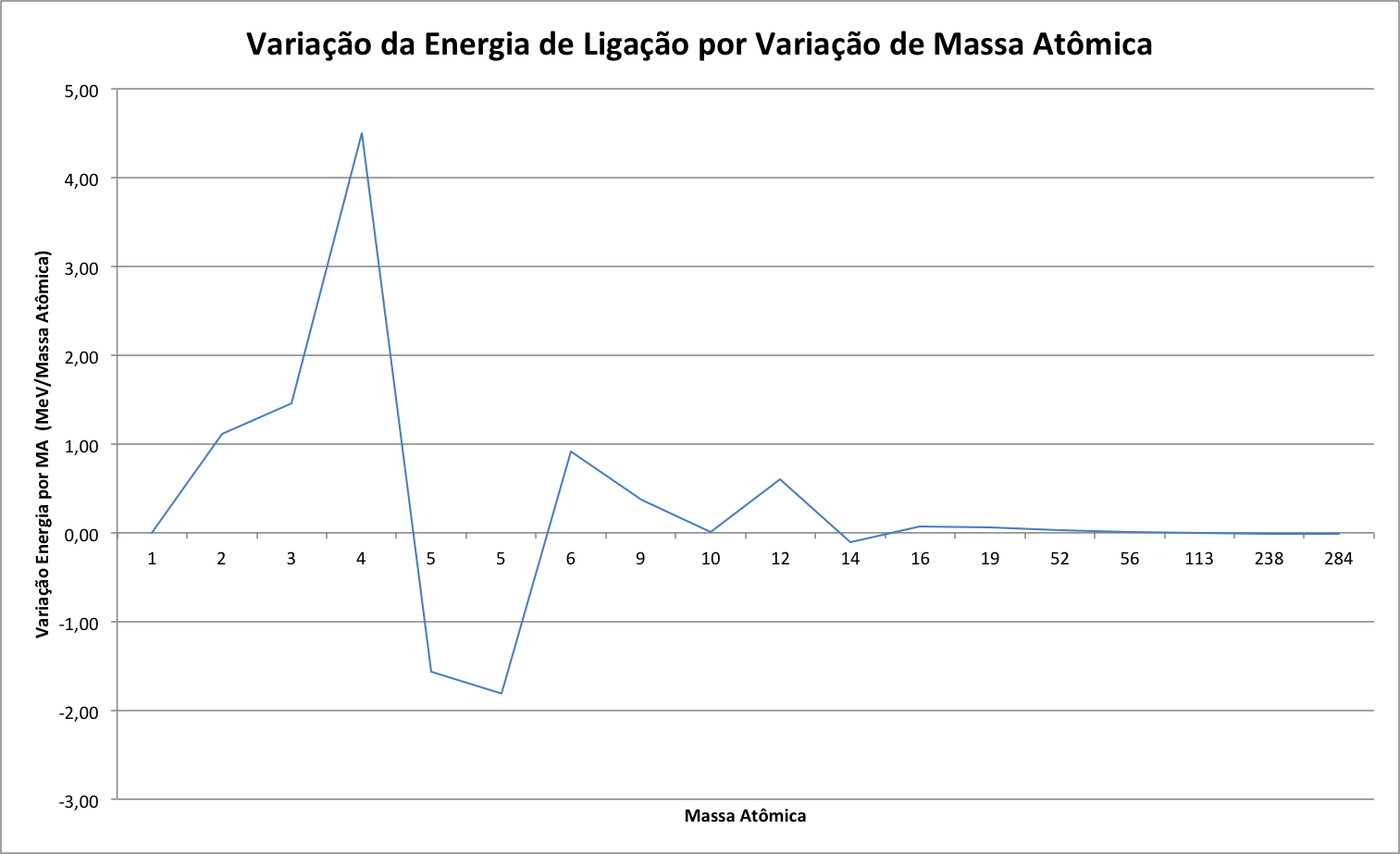
A figura abaixo apresenta a variação da energia de ligação normalizada para diversos nucleóns.
Observa-se que a energia aumenta rapidamente com o aumento da massa atômica até atingir seu máximo com o ferro. A partir dai, a energia diminui com o aumento da massa atômica.
Para que a reação nuclear tenha utilidade na geração de energia, ela precisa ser exotérmica e, de acordo com a figura acima, apenas dois tipos de reação podem ser utilizados na geração de energia:
- A Fusão de dois núcleos leves, do início da curva de energia de ligação, para gerar núcleo mais pesado e com maior energia de ligação;
- A Fissão de um núcleo pesado, do final da curva de energia de ligação, para gerar núcleos mais leves, mas com maior energia de ligação.
Fusão Nuclear
A Fusão Nuclear tem sido considerada o grande avanço tecnológico que revolucionará a geração de energia.
Geração ilimitada de energia, sem emissão de gases tóxicos e geradores do efeito estufa e sem a geração de resíduos radioativos a partir de substâncias disponíveis fartamente em todo o planeta, colocou a Fusão na posição do Santo Graal da geração de energia.
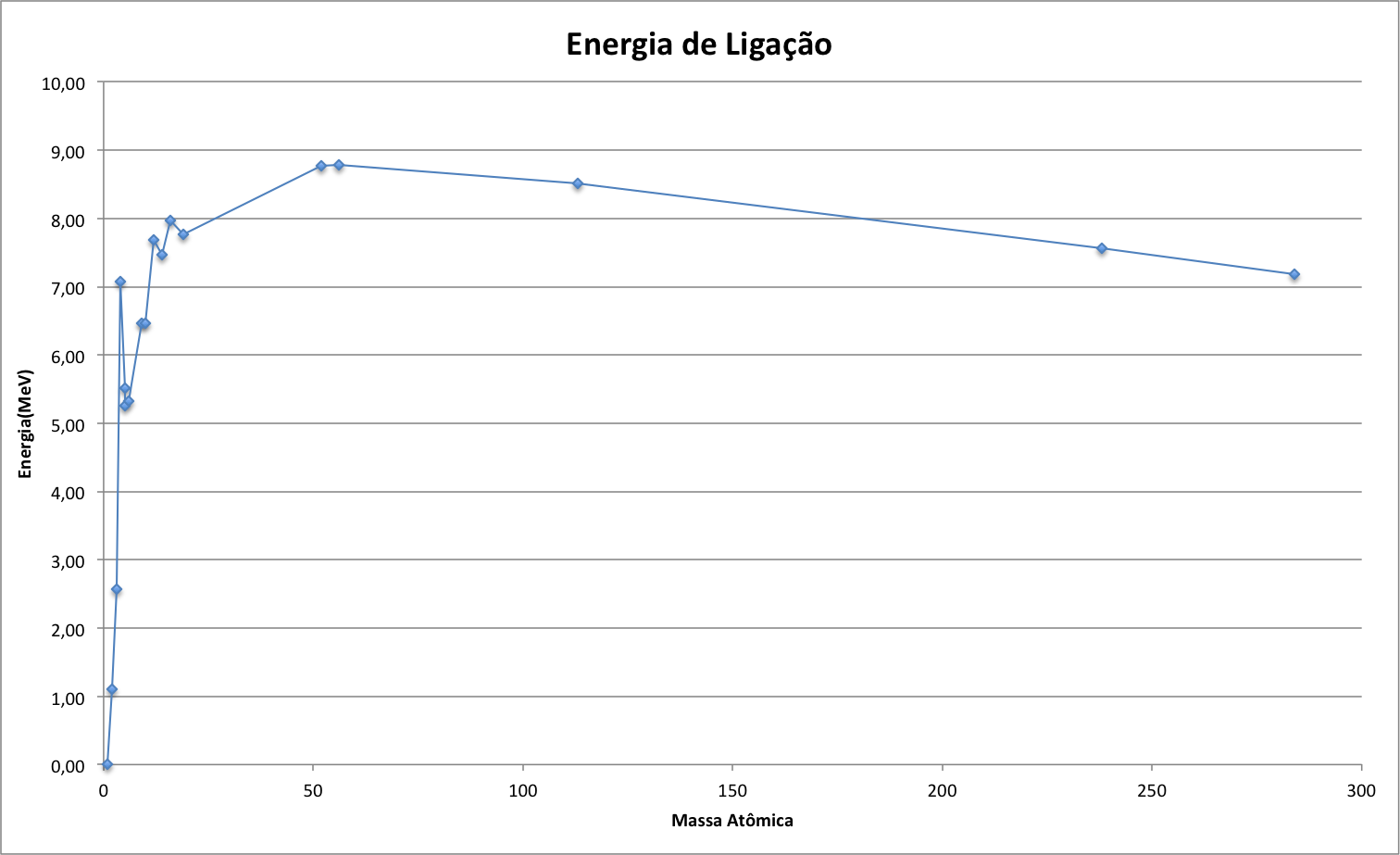
A figura abaixo, obtida a partir dos dados da energia de ligação da figura anterior, apresenta a variação da energia de ligação dividida pela variação da massa atômica. Esta normalização foi necessária porque os dados disponíveis não cobriam continuamente toda a faixa de massas atômicas.
Observa-se que as maiores energias ocorrem com massa atômica 3 e 4. Portanto, os isótopos com estas massas são candidatos para combustível de fusão nuclear.
Consultando a Tabela de Is�topos, constatamos que os elementos adequados para a Fusão Nuclear são os Isótopos de Hidrogênio, conforme mostra a tabela abaixo.
| Isótopo | Massa Atômica | Número Atômico | Abundância | Decaimento | Meia Vida |
|---|---|---|---|---|---|
| Hidrogênio | 1 |
1 |
99,99% |
- |
Estável |
| Deutério | 2 |
1 |
0,01% |
- |
Estável |
| Trítio | 3 |
1 |
- |
Beta-:100% |
12,32 anos |
| 4H | 4 |
1 |
- |
n:100% |
Desconhecida |
| 5H | 5 |
1 |
- |
2n:100% |
< e-15s |
| 3He | 3 |
2 |
0,0001% |
- |
Estável |
| 4He | 4 |
2 |
99,9999% |
- |
Estável |
| 5He | 5 |
2 |
- |
n:100% a:100% |
< e-15s |
| 6He | 5 |
2 |
- |
Beta-:100% |
801 ms |
Como o Deutério é o único Isótopo estável disponível na natureza, ele é o combustível inicial para a geração de energia a partir da fusão nuclear.
As seguintes reações nucleares são possíveis a partir do Deutério e do Trítio.
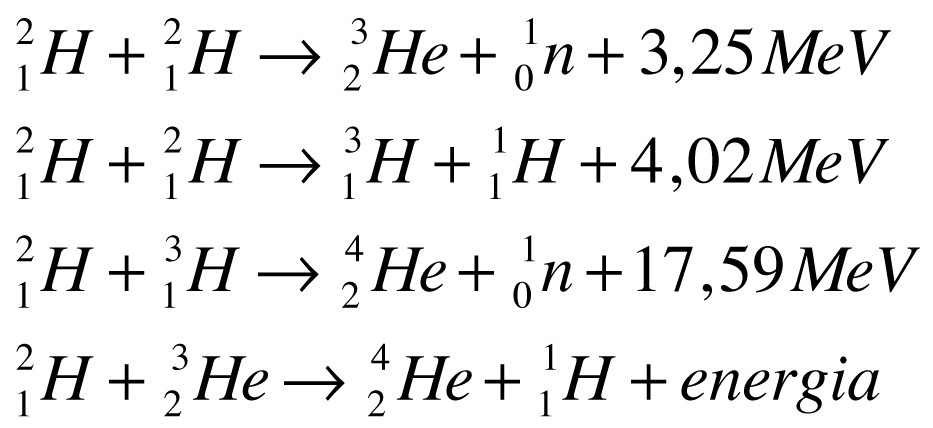
Como apenas o Deutério existe na natureza, ele será sempre o combustível primário para a geração de energia a partir da fusão nuclear.