“Não existe nada além de átomos e vácuo; todo o resto é apenas opinião.”
Democritus, Filósofo Grego
Número Atômico
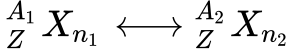
O Número Atômico – Z determina as propriedades químicas dos átomos e corresponde simplesmente ao número de Prótons existentes no seu núcleo. Para garantir a neutralidade elétrica do átomo, o número de prótons deve igualar o número de elétrons.
Onde:
-
- Z é o número atômico;
- ne é o número de elétrons;
- np é o número de prótons.
Massa Atômica
A soma do número de Nêutrons e Prótons determina a Massa Atômica – A dos átomos, outra característica fundamental dos elementos químicos, e é definida como sendo a soma do número de Nêutrons e Prótons do átomo. Evidentemente, este número não tem unidade de massa.
Onde:
-
- A é a massa atômica;
- N é o número de nêutrons;
- Z é o número atômico.
A Tabela abaixo apresenta a massa das três partículas subatômicas mais importantes, do átomo de Hidrogênio, e o de Carbono. A unidade oficial do Sistema Internacional adota o kg como unidade oficial de massa, mas o valor da massa dos elementos químicos em kg necessita de valores numéricos muito pequenos.
Para facilitar os cálculos, os químicos normalizaram a massa e escolheram como base o Carbono. Como a soma de prótons e nêutrons no Carbono iguala a 12, definiram a unidade de massa atômica (uma) como sendo igual a 12. Contudo, a nona edição do Sistema Internacional de Medidas alterou a definição do mol.
| Elemento | massa [kg] | Massa [uma] | Massa [MeV] |
|---|---|---|---|
| Elétron | 9,109E-31 | 5,49E-4 | 0,511 |
| Próton | 1,672e-27 | 1,0072777 | 938,272 |
| Nêutron | 1,675e-27 | 1,008665 | 939,566 |
| Hidrogênio | 1,674e-27 | 1,007825 | 938,7833 |
| Carbono | 1,993e-26 | 12 | 11.177,9 |
| Quark up | 2,3 | ||
| Quark down | 4,8 |
Isótopos, Isóbaros e Isótonos
Em 1912, o químico Frederick Soddy descobriu 40 novos elementos radioativos com massa entre o Urânio e o Chumbo. Contudo, de acordo com a Tabela Periódica, existiam apenas 11 elementos entre esses átomos.
Como explicar este resultado experimental? A Tabela Periódica estava errada ou algo de novo havia sido descoberto?
A explicação dada para acomodar os novos elementos foi a criação do conceito do Isótopo. Isótopos são átomos com mesmo Número Atômico – Z, mas com diferentes Massas Atômicas – A.
Isto só é possível se o número de Nêutrons for diferente.
Como o Número Atômico é igual, as propriedades químicas dos Isótopos são iguais e eles se diferenciam apenas pela massa.
Como a massa do hidrogênio em uma, apresentada na tabela acima, é um número real se a massa atômica, por definição, é um número inteiro?
Como os isótopos não podem ser separados quimicamente, todo o trabalho experimental de medição da massa dos átomos utilizou amostras com diversos Isótopos, em proporções variadas. Isto significa que a massa medida é a média ponderada da massa dos Isótopos existentes na natureza.
Por exemplo, a Massa Atômica do Carbono é 12, mas, como existe seu Isótopo com massa 14, a Massa Atômica média do Carbono é 12,011.
É importante ter em mente este conceito porque, dependendo do problema e/ou contexto, deve-se utilizar a Massa Atômica do isótopo específico ou a massa atômica média do elemento.
Como todo elemento químico é caracterizado por três números, Número Atômico, Massa Atômica e Número de Nêutrons, é possível fazer outros tipos de combinações.
Isóbaros são elementos químicos de mesma Massa Atômica -A– mas Números Atômicos -Z- diferentes.
Isótonos são elementos atômicos com mesmo número de Nêutrons.
A figura abaixo apresenta a representação dos elementos químicos. É importante observar que nem todos os autores seguem a mesma convenção de colocar a Massa Atômica no canto superior esquerdo. Portanto, deve-se prestar atenção neste detalhe ao ler livros de diversos autores. A dica é sempre considerar a massa como sendo o maior número.
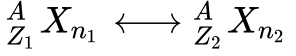
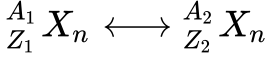
Onde:
-
- X é o símbolo do elemento químico;
- A é a massa atômica;
- Z é o número atômico;
- N é o número de Nêutrons (opcional).
Mol
Qualquer quantidade de material, por menor que seja, contém muitos elementos químicos fundamentais e substâncias diferentes possuem massas diferentes.
Por isso, criou-se a unidade de quantidade de substância, denominada de Mol. Atualmente, o mol passou a ser definido como a quantidade de 6,022 140 76 x 1023 unidades elementares da substância, Número de Avogadro – Na.
A química e a ciência dos materiais utilizam a unidade Mol e diversas propriedades intensivas dos materiais utilizam o Mol.
Configurações Eletrônicas dos Átomos
Os químicos identificaram experimentalmente as configurações eletrônicas dos átomos. Bohr, Schrödinger e outros físicos desenvolveram as teorias para explicar estes resultados experimentais.
A química identificou os seguintes números quânticos:
- Principal n, um número inteiro maior ou igual a 1;
- Momento angular orbital l, outro número inteiro maior do que zero e menor que n;
- Momento magnético orbital ml, outro número inteiro que pode ter apenas os valores 0, +/-1, +/_2, … +/- l;
- Momento magnético do elétron – spin – s, outro número que pode ser apenas +1/2 ou -1/2.
Bohr explicou apenas o número quântico principal – n. Este número está relacionado ao nível de energia do elétron e a linha ocupada pelo átomo na tabela periódica, conforme a Figura 1.
O nível 1, o mais estável, possui a menor energia -13,8 eV, e seu valor negativo resulta da convenção de considerar energia zero na distância infinita.
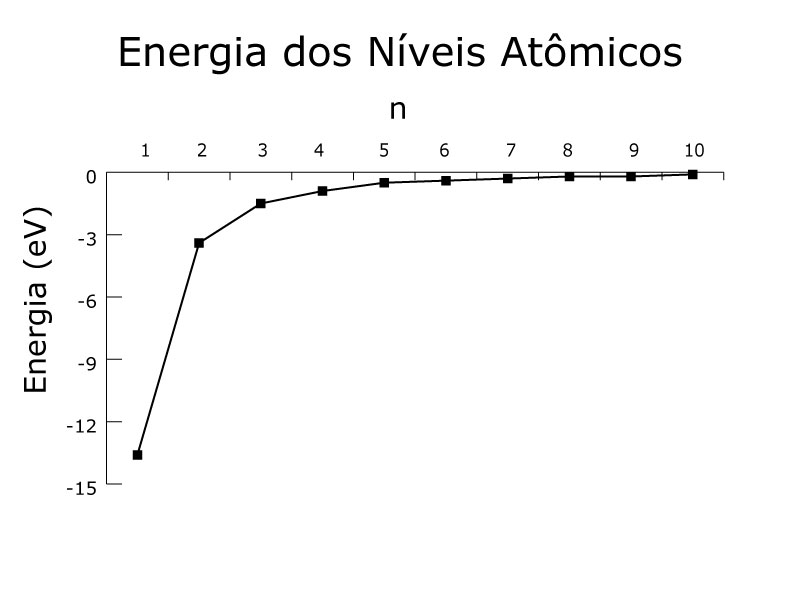
O valor de -13,8 eV corresponde ao átomo de hidrogênio, que possui apenas um próton em seu núcleo. No caso de Z prótons no núcleo, a energia base fica Z2 vezes maior em módulo.
A energia converge para zero com o aumento de N e, por isso, não encontramos átomos na terra além da camada 7.
As equações de Schrödinger forneceram a explicação teórica para os números quânticos. A solução de equações diferenciais fornece os autovalores da equação, e os três primeiros números quânticos são autovalores da equação de Schrödinger.
Schröndiger, com sua equação, explicou o momento angular orbital e o momento magnético orbital. Contudo, não explicou o momento magnético do elétron – spin.
O conceito geométrico das configurações pode ser visto neste link.
Referências
- ROSEMBERG, J.L., EPSTEIN, L.M., KRIEGER, P.J., College Chemistry, 9 edição, McGraw-Hill, 2007.
- TRO, N.J., Introductory Chemistry, 4 edição, Prentice Hall, 2013.
- TILLEY, R.J.D, Understanding Solids – The Science of Materials, 2 edição, Wiley, 2013.