A arrumação dos elementos básicos da matéria (elétrons, átomos e moléculas) afeta as propriedades dos materiais e representa mais um aspecto da estrutura da matéria.
Por sua vez, essa arrumaçao depende das:
-
- Simetrias das moléculas e átomos;
- Forças de atração entre as moléculas e átomos;
- Forças de repulsão entre as moléculas e átomos.
Dependendo deste equilíbrio de forças, existem três estados da matéria: sólido; líquido, gasoso, e plasma.
Plasma
O Plasma consiste no estado da matéria mais abundante no universo, mas inexistente na terra com exceção da ionosfera, dos raios e dos relâmpagos.
O Plasma consiste basicamente em íons e elétrons livres em decorrência de energias elevadas. Por isso, esse estado apresenta elevado comportamento eletromagnético.
Apesar disso, surgiram tecnologias que utilizam esse estado da matéria. Por exemplo, televisão a plasma, gravação a plasma, e a solda a plasma utilizam esse estado da matéria.
Estado Gasoso
No estado gasoso, a energia cinética dos elementos supera as forças de atração. Além disso, a pequena quantidade de elementos garante uma distância média entre eles maior do que o raio de ação das forças de atração.
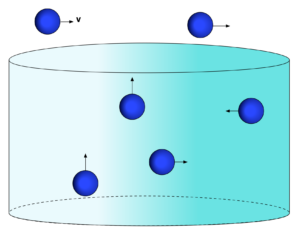
Estado Líquido
No estado líquido, a menor energia cinética dos elementos se torna insuficiente para superar totalmente as forças de atração, mas a maior quantidade de elementos resulta que a distância média seja da ordem de grandeza do raio de ação das forças de atração.
Desta maneira, os elementos ficam ligados dentro do volume que os armazena. Porém, as força de atração não são suficientes para se oporem às forças externas da ordem de grandeza da gravidade.
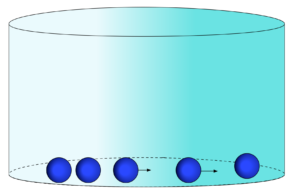
Estado Sólido
No estado sólido, a energia cinética dos elementos se torna menor do que as forças de atração e a quantidade de elementos maior o suficiente para que a distância média seja da ordem de grandeza do raio de ação das forças de atração.
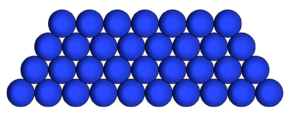
Desta forma os elementos permanecem ligados dentro do volume que minimiza a distância entre os elementos independentemente do volume no qual estão inseridos. Neste caso, as forças de atração suplantam as forças externas.
Portanto, a energia cinética dos elementos representa o papel fundamental na definição do estado da matéria, e esta energia se relaciona diretamente com a temperatura e pressão.
Os elementos básicos da matéria, átomos e moléculas, possuem simetrias e padrões geométricos distintos no estado sólido, explicando as diversas estruturas cristalinas dos materiais sólidos.
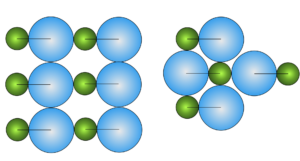
A busca pela configuração de energia mínima determina a estrutura preferencial dos sólidos. Por exemplo, uma molécula composta de dois átomos de tamanhos diferentes e geometria linear pode solidificar de diversas maneiras, mas a estrutura mais compacta se torna sempre a mais estável. Os cristais de gelo são um exemplo prático desta questão. Dependendo das condições de solidificação (temperatura, pressão, etc..) os cristais se formam em padrões distintos.

Em função disso, os sólidos se dividem em Cristalinos e Amorfos. Os primeiros formam estruturas geométricas e os outros não.
Além disso, surgiram novos materiais com propriedades mistas que não se enquadram nas categorias tradicionais.
Estados Modernos da Matéria
Cristal Plástico
Cristais plásticos se encontram entre os estados sólido e líquido e sua identificação somente se torna possível através da difração de Raios-X
Referências
- NEWNHAM, R. E., Properties of Materials – Anisotropy, Symmetry and Structure, Oxford University Press, 2005.