O estado físico e a fase dos materiais dependem da pressão, da temperatura e da estrutura da matéria.
Baixas temperaturas e pressões elevadas favorecem estruturas compactadas da matéria. O aumento da temperatura e diminuição da pressão fornecem energia para que átomos e moléculas se agitem e desfaçam as estruturas compactas.
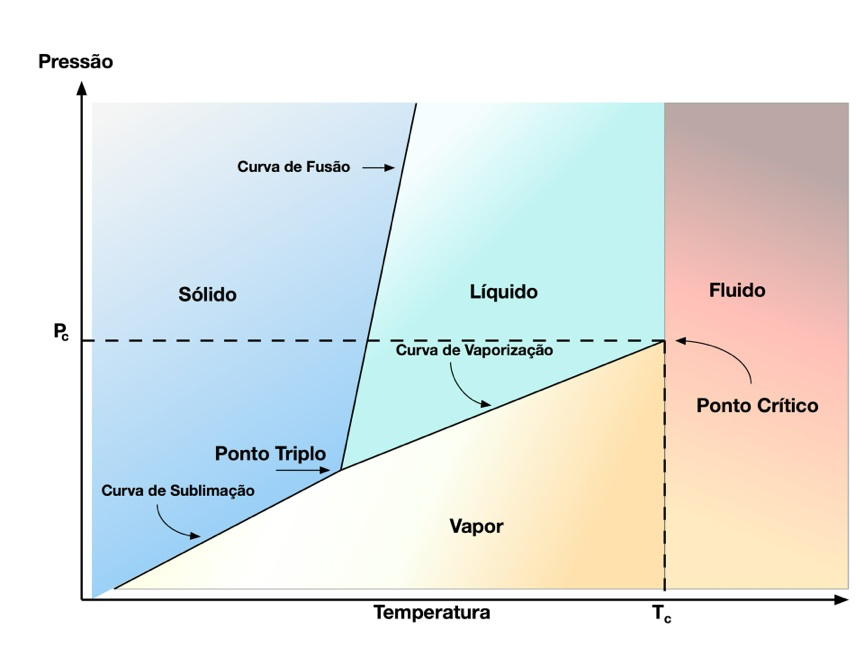
A Figura 1 mostra a relação entre pressão e temperatura genérica dos materiais e as características notáveis dos materiais.
Todos os materiais possuem uma curva desse tipo, a única diferença se encontra nas temperaturas notáveis, pontos críticos e ponto triplo.
O ponto triplo corresponde à pressão e temperatura nas quais os três estados da matéria; sólido, líquido e gasoso coexistem em equilíbrio térmico. Por isso, ele se encontra na interseção das curvas de fusão, vaporização e sublimação das substâncias. O Ponto Triplo possui extrema precisão e, por isso, serve como referência na calibração de termômetros e medidores de pressão.
A curva de fusão representa a região na qual as fases sólida e líquida do material coexistem em equilíbrio.
Analogamente, na curva de vaporização as fases líquida e gasosa do material coexistem, e na curva de sublimação as fases sólida e gasosa se encontram equilibradas.
O pico da curva de vaporização possui uma denominação específica: Ponto Crítico. Neste ponto, a densidade do líquido se iguala a do vapor e, consequentemente, os estados se tornam indistinguíveis. Por isso, esta região recebeu a denominação de fluído.
O Ponto Crítico da água ocorre na temperatura de 647,3 K, pressão de 22,09 MPa e volume específico de 0,0032 m3/kg.
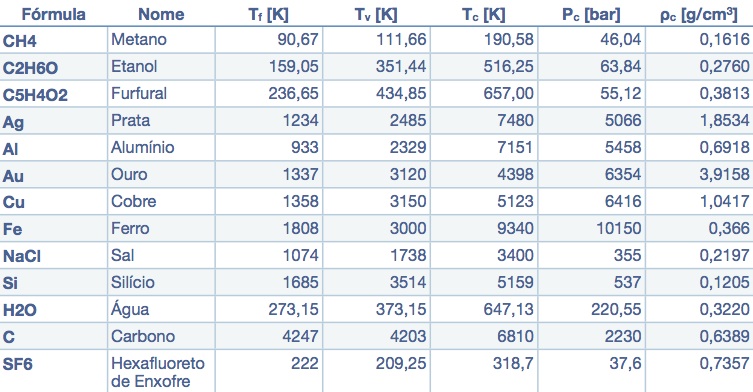
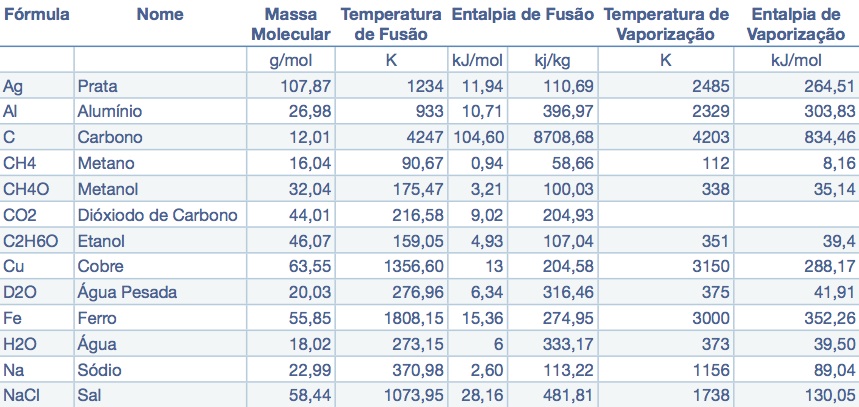
A Tabela 1 apresenta as temperaturas notáveis; temperatura de fusão, temperatura de vaporização e temperatura crítica, de algumas substâncias.
Os materiais podem assumir mais de uma estrutura na fase sólida. Quando isso ocorre, o material possui Formas Alotrópicas.
Por exemplo, o Diamante e a Grafite são formas alotrópicas do Carbono. As formas alotrópicas correspondem a diferentes estruturas cristalinas do material.
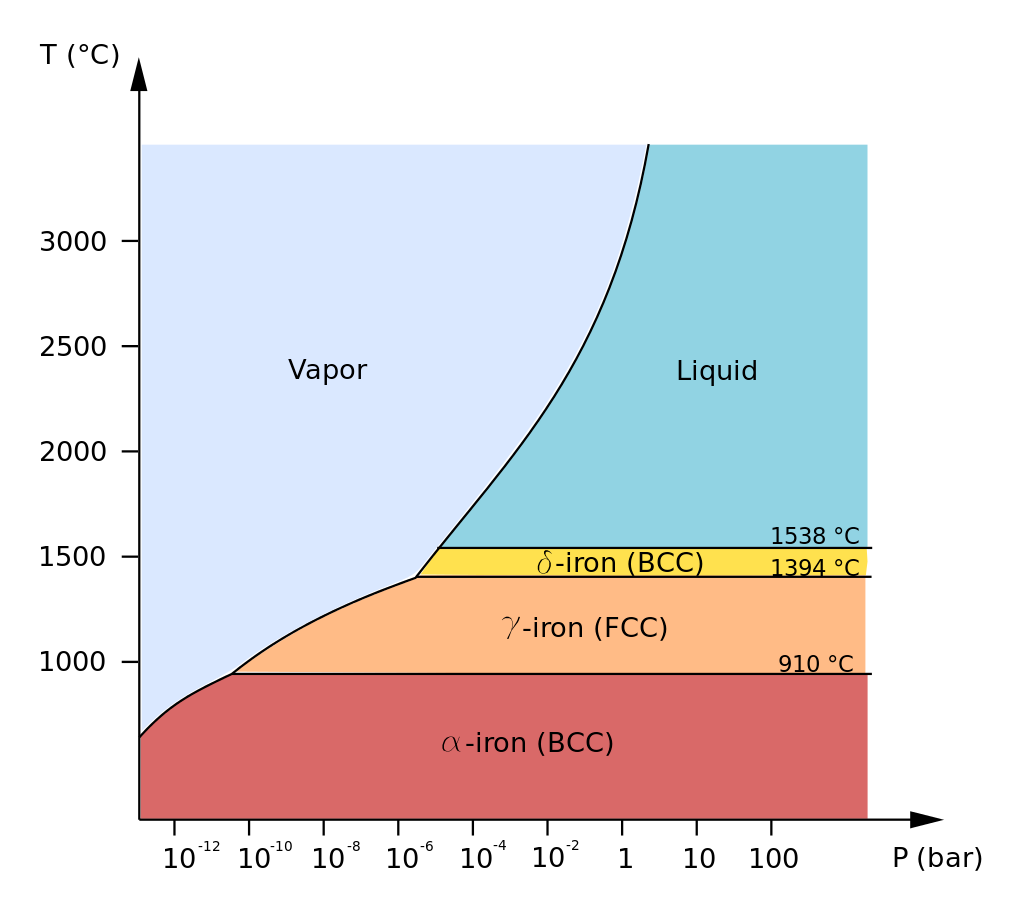
A Figura 2 apresenta as formas alotrópicas do Ferro puro na pressão atmosférica. Conhecer essas fases se torna importante porque resultam em diferentes tipos de aço.
Calor Latente
Quando os materiais mudam de fase, a transferência de calor ocorre sempre com temperatura constante. Isto significa que os processos de mudança de fase são isotérmicos.
Por isso, define-se Calor Latente como o calor necessário para produzir a mudança de fase do material a pressão constante, que equivale à diferença de energia entre os dois estados.
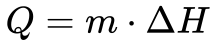
Onde:
-
- Q é o Calor Latente [J];
- m é a massa [kg] ou [mol];
- ΔH é a Entalpia de Fusão, Vaporização ou Sublimação [kJ/kg] ou [kJ/mol].
A Figura 3 apresenta todas as mudanças de fase possíveis e a Equação
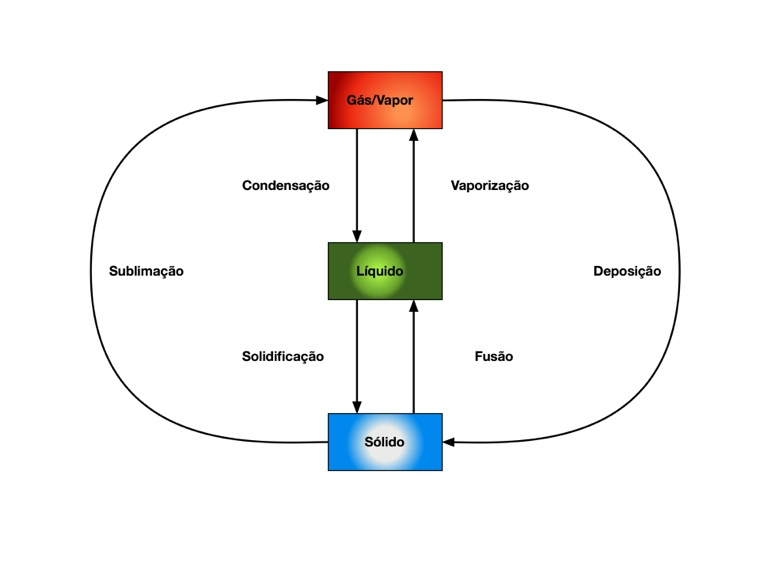
Nas mudanças de fase de sólido para líquido, líquido para vapor e sólido para vapor a energia flui do meio exterior para o material e o oposto ocorre nas mudanças inversas.
Por isso, sentimos uma sensação de frio ao passarmos álcool ou gelo na pele. A evaporação do álcool e a fusão do gelo retiram calor da pele causando a sensação de frio.
Da mesma maneira, a evaporação da chuva no asfalto resfria a rua e a chuva aquece o ar da atmosfera.
Referências
- YAWS, C.L. Chemical Properties Handbook. McGraw-Hill, 1999.
