“A relação humana com a combustão é tão misteriosa quanto cheia de loucura. Da chama da vela à explosão nuclear, iluminou a imaginação humana com medo e fascínio.”
Michael Leunig
A combustão 1 consiste na tecnologia mais antiga da humanidade e base para o funcionamento das máquinas térmicas utilizadas na geração de energia elétrica. Ela resulta da oxidação exotérmica de diversas substâncias, e depende de vários fatores (combustível, mistura ar-combustível, temperatura etc.). Seu estudo envolve química, termodinâmica e mecânica dos fluidos.
A combustão rápida consiste na oxidação que produz calor e luz, e a combustão lenta na que produz apenas calor. A combustão lenta se encontra associada aos organismos vivos.
A combustão necessita da mistura correta de combustível e comburente (normalmente ar). Contudo, nem sempre ela ocorre espontaneamente nas condições ambientes. Dependendo do combustível, a combustão necessita de um elemento catalisador externo para iniciar. Denomina-se de ignição este processo externo. A combustão pode ocorrer de duas maneiras; com chama e sem chama. Na maioria dos processos de combustão, obtém-se o oxigênio (comburente) necessário a partir do ar atmosférico.
A combustão com chama ocorre em região delimitada do espaço, podendo se propagar, ou não. De um lado da fronteira existem os gases quentes resultantes da combustão e do outro existem apenas os gases não queimados. A lamparina e a queima no cilindro de motores de combustão interna com vela de ignição exemplificam este tipo de combustão. Além disso, a combustão com chama classifica-se em pré-misturada ou difusa, conforme mostra a Figura 1.
Na combustão pré-misturada, o combustível se combina homogeneamente com o comburente a nível molecular antes da reação química iniciar. O motor de combustão interna com vela de ignição exemplifica esse tipo de combustão.
Por outro lado, na chama difusa os reagentes se encontram inicialmente separados e a combustão ocorre apenas na região onde o combustível se mistura com o comburente. O motor diesel e a lamparina exemplificam a combustão com chama difusa.
A relação entre a velocidade de mistura dos componentes da combustão e a velocidade da combustão diferencia a combustão difusa da pré-misturada (Glassman). Portanto, pode-se controlar a combustão através da velocidade de mistura e, consequentemente, a potência da máquina térmica.
A combustão sem chama ocorre quando o processo de combustão acontece simultaneamente em diversos pontos da mistura combustível-comburente. Neste caso, não existe uma região definida denominada de chama e o processo é volumétrico. Este tipo de combustão ocorre em motores diesel e na detonação indevida em motores de combustão interna com vela de ignição, fenômeno mais conhecido como “bater pino”.
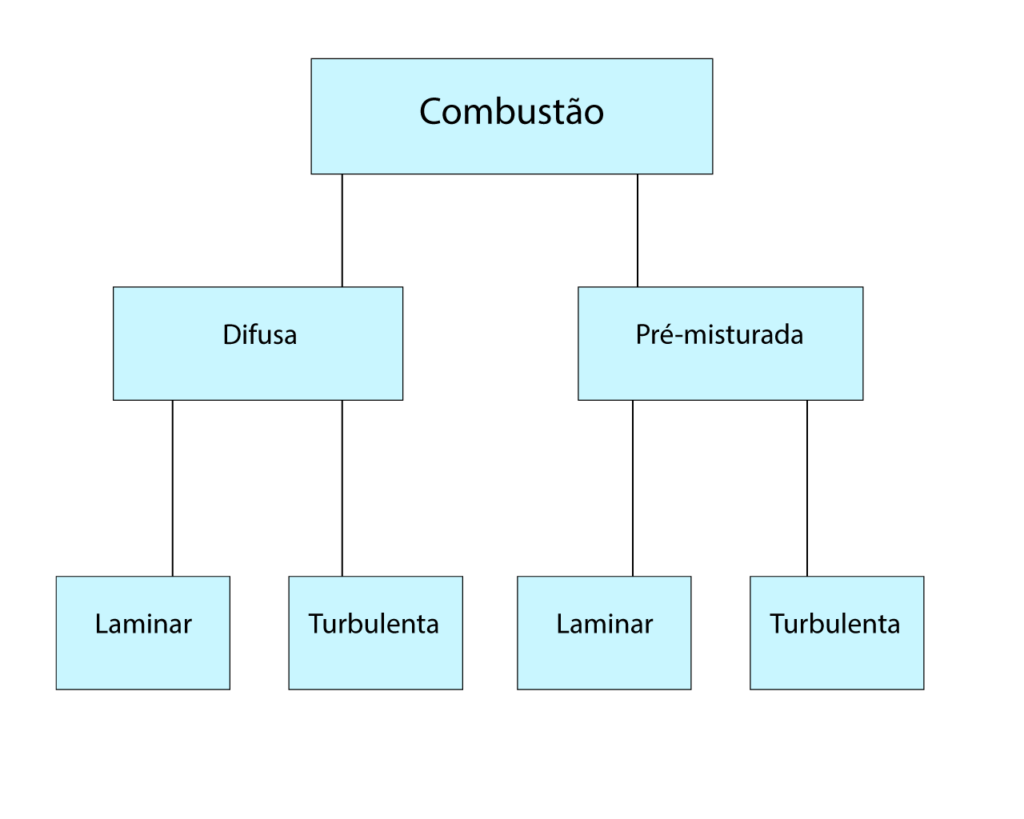
A mecânica dos fluidos determina a característica laminar ou turbulenta da chama. De acordo com a Figura 1, as máquinas térmicas operam sempre com escoamento turbulento. Além disso, a tabela abaixo mostra outros fatores extremamente importantes no processo de combustão.
| Fatores | Classificação | Exemplos |
| Fases da mistura | monofásico
multi fases |
motor a vela
Caldeira a carvão |
| Velocidade | Detonação
Deflagração |
Explosão
Processo normal |
| Pressão |
Normal Elevada |
Caldeiras
Motores |
Combustão do Carbono
A Equação 1 apresenta a combustão do carbono.
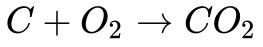
Esta equação significa que 1 mol de carbono ao reagir com 1 mol de oxigênio forma 1 mol de dióxido de carbono liberando energia. Ela também significa que 12 kg de carbono reagem com 32 kg de oxigênio para gerar 44 kg de dióxido de carbono liberando, de acordo com a Tabela, 109 kWh (9,09 kWh/kg) de energia térmica. 2 Do ponto de vista ambiental, esta reação gera 3,66 kg de dióxido de carbono por kg de carbono ou 0,403 kgCO2/kWh.
Combustão Incompleta do Carbono
As seguintes reações ocorrem quando a combustão total do Carbono não se completa:
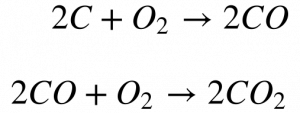
Essa reação predomina quando a quantidade de carbono supera a quantidade de oxigênio necessária na zona de combustão. Apesar do monóxido de carbono não ser combustível industrial, ele queima e participa do processo de combustão. O poder calorífico do monóxido de carbono é três vezes menor do que o do Carbono, conforme a Tabela. O projeto das máquinas térmicas deve considerar esta queima parcial do Carbono e garantir ao máximo a queima do Monóxido de Carbono para limitar a emissão deste gás venenoso.
Combustão do Hidrogênio
A combustão do hidrogênio, o elemento mais leve da tabela periódica, ocorre de acordo com a Equação 3.
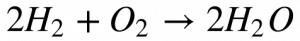
Observa-se que a água consiste no único produto desta reação e libera a maior quantidade de energia dentre todos os combustíveis. Por isso, considera-se o Hidrogênio como o combustível mais limpo do ponto de vista ambiental, mas sua utilização se encontra ainda limitada em decorrência de fatores econômicos e de segurança.
Combustão do Metano
O Metano, o hidrocarboneto mais simples, ao queimar produz dióxido de carbono e água, conforme a reação abaixo:
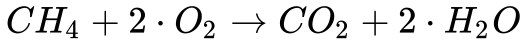
Neste caso, 16,04 kg de metano geram 44 kg de dióxido de carbono. Ou seja, apenas 2,74 kg de dióxido de carbono são gerados por kg de metano. Isto representa 25% menos dióxido de carbono por quilo de combustível se comparado com o carbono.
Do ponto de vista energético, os 16,04 kg de Metano geram 222,6 kWh (13,88 kWh/kg), que representa 0,20 kgCO2/kWh. Isto significa que o Metano gera cerca da metade do CO2 gerado pela combustão do carbono por energia térmica liberada. 3
Combustão de Hidrocarbonetos
A Equação 5 apresenta a combustão de um hidrocarboneto genérico.
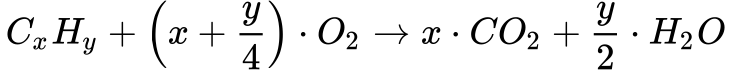
Observa-se que, quanto maior o número de átomos de carbono maior a quantidade de dióxido de carbono gerada. No entanto, conforme mostra a tabela abaixo, o aumento do número de carbono no hidrocarboneto satura logo o índice de massa de CO2 por massa de combustível queimado e o índice de massa de CO2 por energia térmica liberada.
Problema proposto
Por que o índice de massa de CO2 emitida na combustão por massa de combustível dos hidrocarbonetos satura?
Desta forma, considerando a emissão do Metano como sendo 100%, a emissão dos hidrocarbonetos se torna 30% maior e a do carvão 100% maior do que a emissão de CO2 originada pela queima de Metano. Os hidrocarbonetos apresentados na Tabela foram escolhidos porque representam a composição da gasolina, diesel e óleo combustível.
Combustão de Álcoois
A Equação 6 apresenta a combustão de álcool genérico.
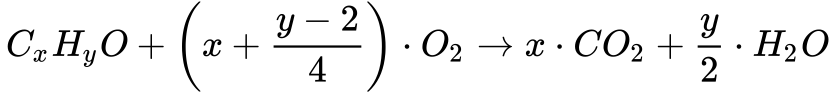
Observa-se que os álcoois possuem um poder calorífico inferior ao poder calorífico dos hidrocarbonetos – 44% no caso do Metanol e 60% no caso do Etanol. Por isso, os carros consomem mais álcool – Etanol – do que gasolina por km rodado. 4
Tabela 1. Combustão de Hidrocarbonetos
EC - Entalpia de Combustão
Combustível EC M1 M2 M2/M1 M2/EC M2/EC
Normalizado
kWh/kg kg kg kg/kg kg/kWh %
Metano
CH413,9 16 44 2,74 0,197 100
Octano
C8H1812,3 114,2 352,1 3,08 0,251 127
Duodecano
C12H2612,3 170,3 528,1 3,10 0,253 128
Cetano
C16H3412,2 226,4 704,2 3,11 0,255 129
Metanol
CH4O5,5 32 44 1,37 0,248 126
Etanol
C2H6O7,4 46,1 88 1,91 0,256 130
Carbono
C9,1 12 44 3,66 0,403 204
M1 - massa de combustível
M2 - Massa de CO2
Yaws, Carl L. "Enthalpy of Combustion." Chemical Properties Handbook: Physical, Thermodynamic, Environmental, Transport, Safety, and Health Related Properties for Organic and Inorganic Chemicals. New York: McGraw-Hill, 1999. 779. Print.
Com relação às emissões de CO2, os álcoois emitem menores quantidades de CO2 por massa de combustível. Contudo, como eles apresentam poder calorífico menor, a emissão de CO2 por energia gerada se torna praticamente igual à dos hidrocarbonetos. Porém, como eles são obtidos a partir da cana de açúcar e do milho, o CO2 emitido é reabsorvido pelo crescimento dos vegetais.
Combustão do Enxofre
A maioria dos combustíveis utilizados na geração de energia apresenta quantidades de enxofre na sua composição química. Este elemento, ao entrar em contato com o oxigênio, pode queimar de acordo com a seguinte reação:
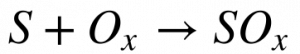
Onde:
-
- x é um número inteiro.
O poder calorífico desta reação é inferior ao poder calorífico do Carbono. Por isso, a combustão do enxofre rouba oxigênio, produz menos energia do que o Carbono, e seus produtos (SOx) provocam malefícios ao meio ambiente. Em decorrência disso, existe um crescente esforço mundial para reduzir a quantidade de enxofre dos combustíveis e de retirá-lo dos gases oriundos da combustão.
Combustão com Ar
As análises anteriores consideraram a combustão com oxigênio puro. Apesar desta combustão ser mais eficiente do ponto de vista energético, as máquinas térmicas utilizadas na geração de energia utilizam o ar por questões de custo. O ar atmosférico, uma solução de gases, possui a seguinte composição aproximada:
-
- 21% de oxigênio;
- 78% de nitrogênio;
- 1% de argônio.
Por isso, aproxima-se a composição do ar por Nitrogênio (79% vol) e do Oxigênio (21% vol) de acordo com a Equação 8. 5:
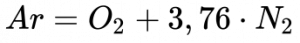
Por ser inerte, ele não participa do processo de combustão6 e as equações de combustão se tornam as equações abaixo. Convém lembrar que se gasta parte da energia gerada pela combustão no aquecimento do nitrogênio e a parcela de oxigênio utilizada na formação de NOx deixa de participar do processo de combustão. Consequentemente, a presença do Nitrogênio no ar reduz a energia disponível para as máquinas térmicas, que necessitam aspirar mais ar para garantir a queima completa do combustível, contribuindo para a redução no rendimento do processo.
Combustão Hidrocarbonetos
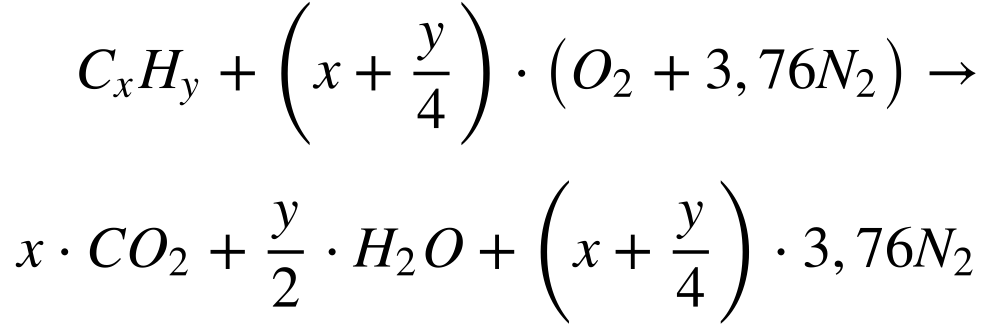
Combustão Álcoois
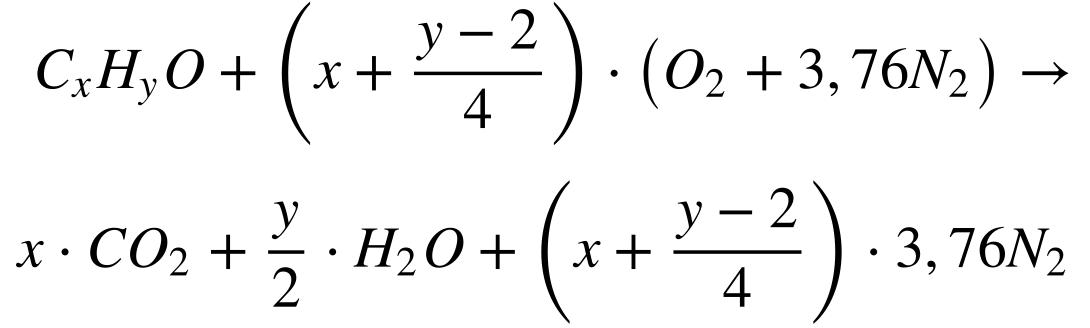
Combustão Estequiométrica
A intensidade da combustão depende da quantidade relativa de combustível e comburente. Denomina-se de combustão estequiométrica aquela na qual a quantidade de comburente oxidante produz a queima total do combustível. As expressões de combustão apresentadas anteriormente são todas estequiométricas. Nestas condições, obtemos máxima eficiência na combustão.
Denomina-se de Mistura Rica quando a quantidade de comburente não garante a combustão completa do combustível. Isto significa que existe uma quantidade maior de combustível do que ar e as consequências são:
-
- desperdício de combustível,
- menor eficiência,
- emissões de CO,
- emissões de hidrocarbonetos.
Neste caso, todo o oxigênio reage, mas o Monóxido de Carbono e Hidrogênio aparecem com os produtos da reação.
Por outro lado, denomina-se Mistura Pobre quando a quantidade de comburente supera a quantidade necessária. Neste caso, existe mais ar do que combustível, e considera-se que todo o Carbono se transforma em Dióxido de Carbono, todo o Hidrogênio em água, e o excesso de oxigênio permanece sem reagir.
Para se medir corretamente a concentração de combustível e comburente numa mistura, define-se a relação combustível oxidante da seguinte maneira:
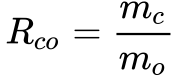
Quando se utiliza o ar como oxidante, vale a seguinte relação:
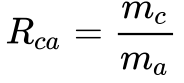
Onde:
-
- mc é a massa de combustível;
- mo é a massa de oxidante;
- ma é a massa de ar.
Alguns autores utilizam a relação inversa, isto é relação ar combustível – Rac.
Apesar dessas relações serem adimensionais, torna-se conveniente normalizá-las tendo como base a relação estequiométrica. Desta forma, define-se a relação normalizada combustível oxidante da seguinte maneira:
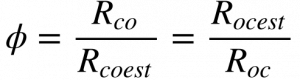
Onde:
-
- Φ é a relação combustível oxidante normalizada;
- o subscrito est significa a grandeza estequiométrica.
Esta relação varia entre zero (massa de combustível zero) e infinito (massa de comburente zero), dependendo da quantidade de combustível e de comburente.
A tabela abaixo classifica as misturas de acordo com a relação combustível comburente normalizada.
|
|
Mistura
|
|
|---|---|---|
|
<1
|
Pobre de Combustível
|
Pobre
|
|
=1
|
Estequiométrica
|
Estequiométrica
|
|
>1
|
Rica de Combustível
|
Rica
|
A assimetria da relação combustível oxidante normalizada levou alguns autores a utilizar a seguinte definição:
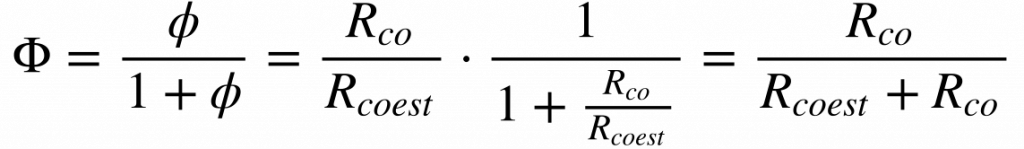
Neste caso, o parâmetro Φ varia entre zero e 1, e as propriedades se transformam nas apresentadas na tabela abaixo.
|
|
Mistura
|
|
|---|---|---|
|
<0,5
|
Pobre de Combustível
|
Pobre
|
|
=0,5
|
Estequiométrica
|
Estequiométrica
|
|
>0,5
|
Rica de Combustível
|
Rica
|
Exemplo
Considerando a relação estequiométrica ar combustível do Metano igual a:
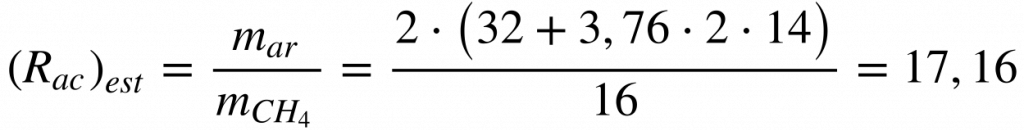
Isto significa que se necessita de 17 vezes mais ar, em massa, do que Metano para haver combustão estequiométrica.
De acordo com Garcia7, a Equação 16 fornece a massa de oxigênio necessária para realizar a combustão estequiométrica de determinado combustível cuja composição seja conhecida:
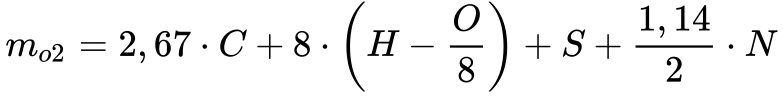
Onde:
-
- mo2 é a massa de oxigênio [kg/kg de combustível];
- C é a massa de carbono no combustível [kg/kg de combustível];
- H é a massa de hidrogênio no combustível [kg/kg de combustível];
- O é a massa de oxigênio no combustível [kg/kg de combustível];
- N é a massa de nitrogênio no combustível [kg/kg de combustível];
- S é a massa de enxofre no combustível [kg/kg de combustível];
Também segundo Garcia, a Equação 17 fornece o volume de oxigênio necessário para a combustão estequiométrica de determinado combustível:
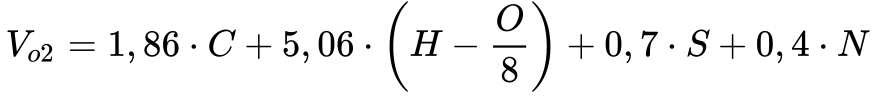
Onde:
-
- Vo2 é o volume de oxigênio puro [m3 @ 0°C e 0,1MPa]8
Considerando o ar como comburente, a massa necessária para realizar a combustão estequiométrica de determinado combustível será dada pela Equação 18.
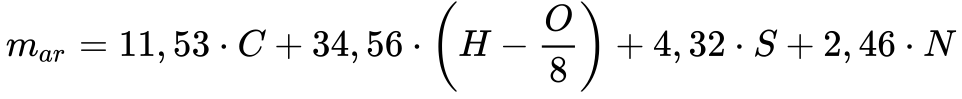
Onde:
-
- mar é a massa de ar [kg/kg de combustível]
Analogamente, a Equação 19 fornece, segundo Garcia, o volume de ar necessário para a combustão estequiométrica de determinado combustível.
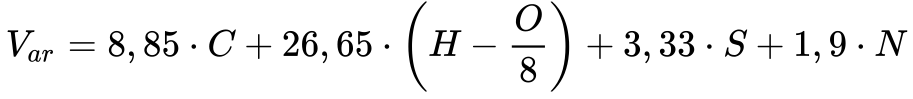
Onde:
-
- Var é o volume de ar [m3/kg @ 0°C e 0,1MPa].
Na prática, utiliza-se mais comburente do que a quantidade estequiométrica porque as máquinas térmicas devem garantir a queima completa do combustível. A tabela abaixo9 mostra que o excesso de ar deve ser maior quando se utiliza combustíveis sólidos do que quando se usa combustíveis gasosos. A maior facilidade de misturar o comburente gasoso com combustíveis gasosos explica esta constatação prática.
| Combustível | Excesso de Ar |
|---|---|
| Gasoso |
0% a 10%
|
| Líquido |
0% a 18%
|
| Sólido |
12% a 15%
|
Referências
- GARCIA, ROBERTO. Combustíveis E Combustão Industrial. Rio De Janeiro: Interciência, 2002. Print.
- Glassman, Irvin, and Richard Yetter. Combustion. 4rd ed. San Diego, Calif.: Academic, 2008. Print.
-
Turns, Stephen R. An Introduction to Combustion: Concepts and Applications. 2nd ed. Boston: WCB/McGraw-Hill, 2000. Print.
-
Warnatz, J., and U. Maas. “Introduction.” Combustion Physical and Chemical Fundamentals, Modeling and Simulation, Experiments, Pollutant Formation. 3th ed. Berlin: Springer, 2001. Print.
- Williams, Forman. Combustion Theory. 2nd ed. Benjamin/Cummings, 1985. Print.
-
Winterbone, D. E. “Thermodynamics of Combustion.” Advanced Thermodynamics for Engineers. London: Arnold, 1997. Print.
- Yaws, Carl L. Enthalpy of Combustion. Chemical Properties Handbook: Physical, Thermodynamic, Environmental, Transport, Safety, and Health Related Properties for Organic and Inorganic Chemicals. New York: McGraw-Hill, 1999. 779. Print.
