“A energia nuclear, em termos de histórico de segurança, é melhor do que as outras energias.”
O estudo das reações nucleares demanda muito tempo devido à sua complexidade. No entanto, do ponto de vista de geração de energia, utilizam-se modelos simplificados para compreender o funcionamento dos reatores nucleares.
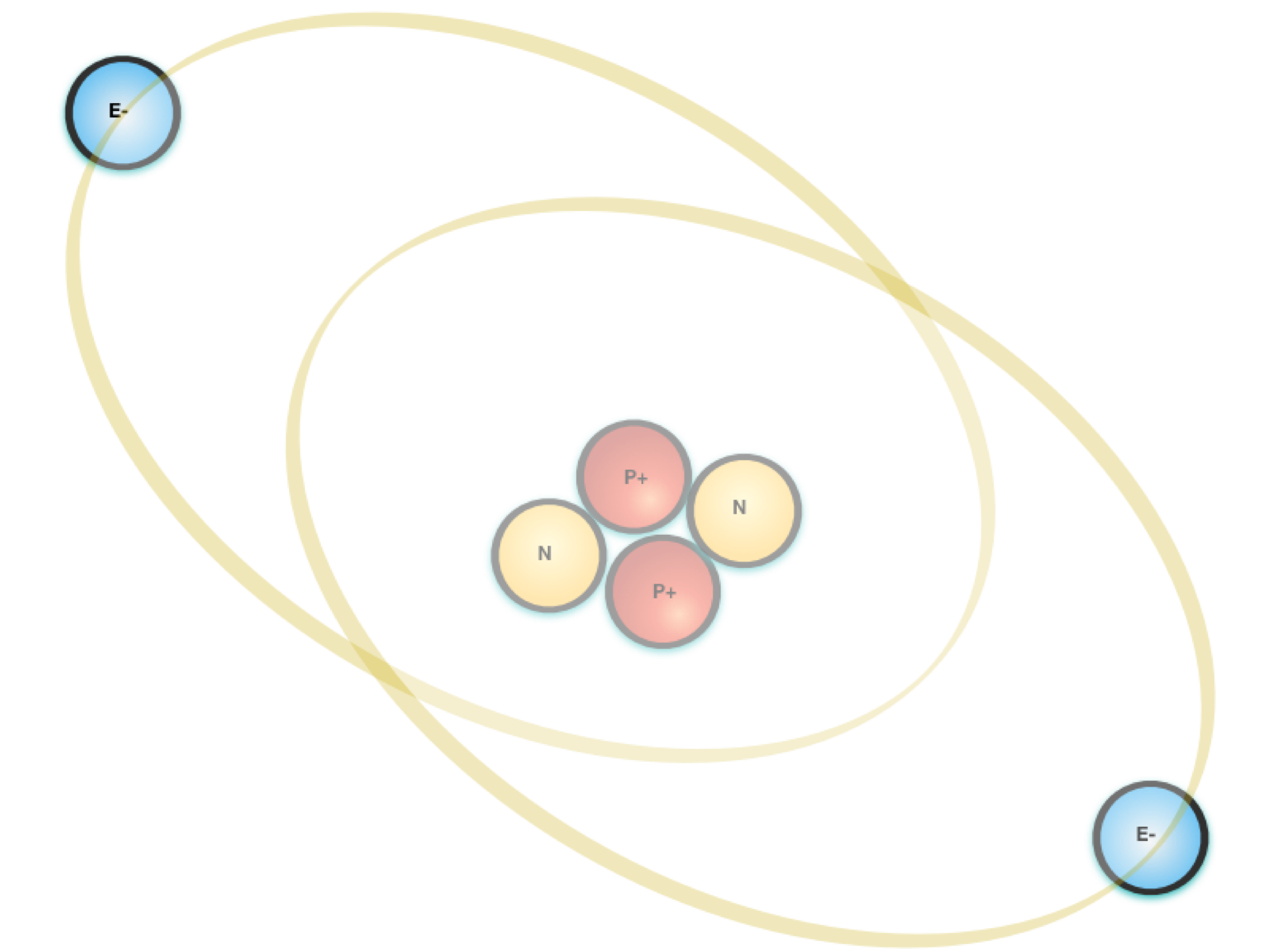
O modelo atual do átomo consiste em um núcleo denso polarizado positivamente – Prótons e Nêutrons, envolvido por cargas polarizadas negativamente – os elétrons, conforme mostra a Figura 1.
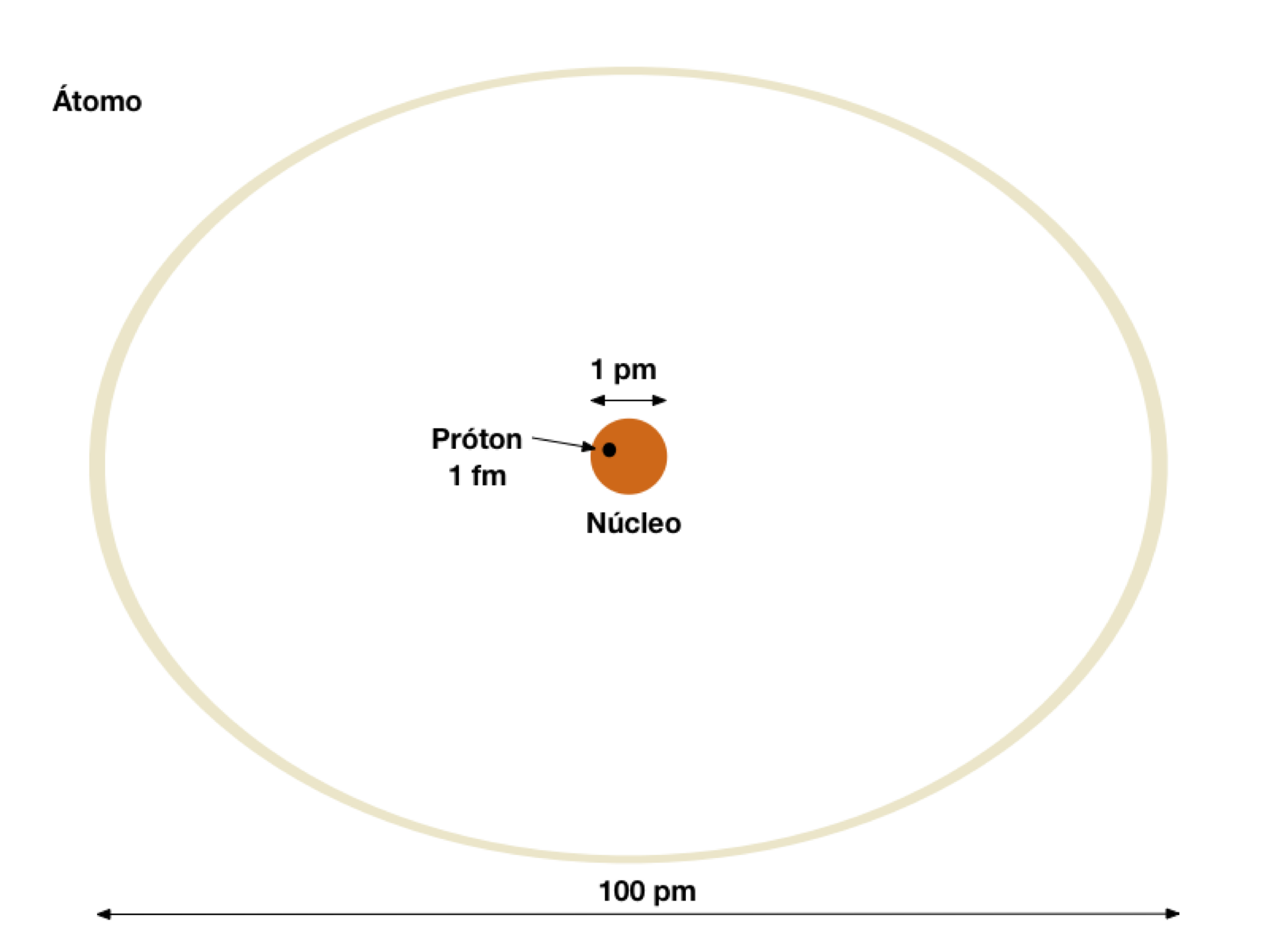
Conforme mostra a Figura 2, o Átomo possui muito espaço vazio sendo seu diâmetro cem vezes maior do que seu núcleo.
A nuvem de elétrons forma uma barreira eletrostática que dificulta a aproximação de cargas eletricamente carregadas no núcleo.
Nucleons – Z prótons e N nêutrons formam o núcleo dos átomos. O número de prótons Z, conhecido como número atômico, define as propriedades químicas do elemento.
Por outro lado, o número de nucleons – A – determina a massa atômica.
A Equação 1 apresenta a forma normalmente utilizada para representar os elementos nas equações de reações nucleares.
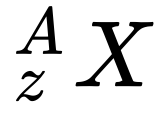
Onde:
-
- Z é o número de prótons ou número atômico;
- A é a massa atômica, que é igual à soma do número de Prótons e Nêutrons do átomo.
Deve-se observar que a posição relativa da massa atômica e do número atômico pode variar dependendo da origem do autor. Contudo, como a massa atômica é sempre maior ou igual ao número atômico, torna-se fácil verificar a convenção utilizada.
Denomina-se de Isótopos os núcleos com o mesmo número atômico, mas massa diferente. Eles possuem as mesmas propriedades químicas, mas possuem massa diferente porque possuem quantidades distintas de Nêutrons.
Reações Nucleares
As reações nucleares podem ser escritas das seguintes maneiras:
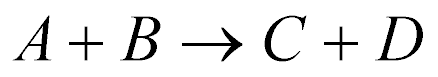
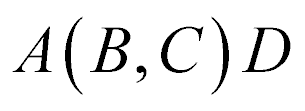
Os Nucleons com menor número atômico normalmente aparecem entre os parênteses.
Exemplo:
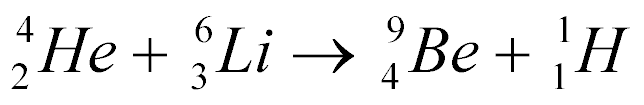
Esta equação não explica como ela acontece, não explica se libera ou absorve energia, mas obedece às seguintes leis; conservação da carga e conservação de Nucleons.
Estes princípios estabelecem que a quantidade de cargas e de Nucleons devem permanecer constantes apesar da reação. Isto significa que o somatório dos índices subscritos e dos sobrescritos devem ser iguais nos dois lados da equação. 1
As reações nucleares ocorrem normalmente em mais de um estágio. Inicialmente, surge um núcleo instável que se divide posteriormente em dois componentes.
Dependendo do que se deseja estudar, o estágio intermediário pode ser desprezado, a menos que o tempo de desintegração seja significante.
Por exemplo, a captura de um Nêutron pelo Índio-116 gera o Índio-117 com emissão de raios gama, conforme a equação abaixo:
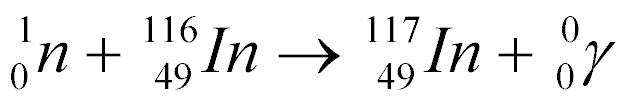
Por ser instável, o Índio-117 decai da seguinte maneira:
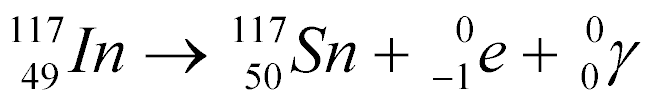
O decaimento de isótopos necessita de um determinado tempo para se completar e este tempo depende do isótopo em questão. Este tempo pode variar de milissegundos a anos.
Por isso, define-se a meia vida de determinado isótopo como sendo o tempo necessário para que metade dos nucleons originais decaia.
Omite-se algumas vezes os raios gama das reações nucleares porque não afetam o balanço de cargas e nucleons. Isto ocorre, porque eles não possuem massa nem carga. No entanto, deve-se considerá-los no balanço de energia.
Após uma colisão nuclear, reação ou decaimento, o núcleo fica excitado. Quando ele relaxa e passa para o estado não excitado, ele emite raios gama.
Os raios emitidos possuem energia proporcional à diferença entre os níveis quânticos de energia do núcleo excitado e estável.
Este fenômeno equivale à emissão de fótons originada pela mudança de nível de energia dos elétrons que orbitam o núcleo.
A diferença entre eles reside quantidade de energia envolvida. A energia relacionada à emissão de fótons se encontra da faixa de eV, enquanto a associada aos raios gama ocorre na ordem de MeV.
Resumindo, esta esses são os fenômenos relacionados com a radioatividade.
Partículas Atômicas
Em 1896, o físico francês Antoine Henri Becquerel, em seus estudos sobre substâncias fosforescentes, verificou que compostos de urânio, causavam manchas escuras em chapas fotográficas.
Mais tarde, ele pode evidenciar que o fenômeno de fosforescência não ocasionava a radiação emitida pelo composto de urânio, mas, ao contrário, uma radiação invisível do composto de Urânio produzia o fenômeno de fosforescência.
O composto de urânio possui uma propriedade, até então desconhecida, de emitir “raios invisíveis”.
A partir de 1898, o estudo da radioatividade se desenvolveu e outros elementos radioativos foram descobertos, inclusive o rádio, de onde veio o nome “radioativo”.
Um elemento radioativo2 emitindo radiação em um campo elétrico permitiu a identificação de três tipos de radiação: Raios Gama, Raios Beta e o Raios Alfa.
Por isso, define-se Radiação Nuclear como as partículas e energia eletromagnética liberado pelo núcleo dos átomos a partir de reações nucleares.
Radioatividade
A radioatividade resulta do decaimento radioativo de núcleos instáveis.
Como ainda se desconhece detalhes dessas reações, descreve-se o comportamento dos elementos radioativos através da estatística.
Meia-vida consiste no tempo necessário para que metade da massa dos nucleons de um isótopo radioativo decaia.
Por exemplo, o Indio-117 possui meia-vida de 54 minutos, enquanto a meia-vida do Urânio-234 se encontra próxima a 245 mil anos.
Os primeiros estudiosos da radioatividade descobriram que os Raios Alfa sofriam atração para a placa negativa, permitindo que se identificasse sua carga positiva. Verificou-se posteriormente que esta radiação era na verdade uma partícula composta por dois Prótons e 2 Nêutrons 3.
As partículas alfas possuem alta energia cinética, pois o núcleo, além de liberar os prótons e neutron, também libera energia, na forma de energia cinética.
Por terem massa e carga elétrica maiores que o raios Beta e Gama, as partículas Alfa possuem menor capacidade de penetrar na matéria, podendo ser bloqueadas por uma folha de papel.
Por isso, elas oferecem menos perigo aos organismos vivos, desde que não penetrem neles. Se isso ocorrer, ela pode causar sérias lesões.
O átomo que produz uma Partícula Alfa também sofre alteração significativa porque o número de prótons no núcleo determina as propriedades químicas dos átomos.
Dessa forma, ao emitir uma Partícula Alfa, o átomo perde dois prótons, e assim passa a se comportar de forma diferente em termos químicos, ou seja, de suas combinações com outros átomos para formar compostos.
A Figura 3 apresenta o decaimento radioativo através da emissão de partículas alfa – Decaimento Alfa, que não passa do núcleo de um átomo de Hélio.
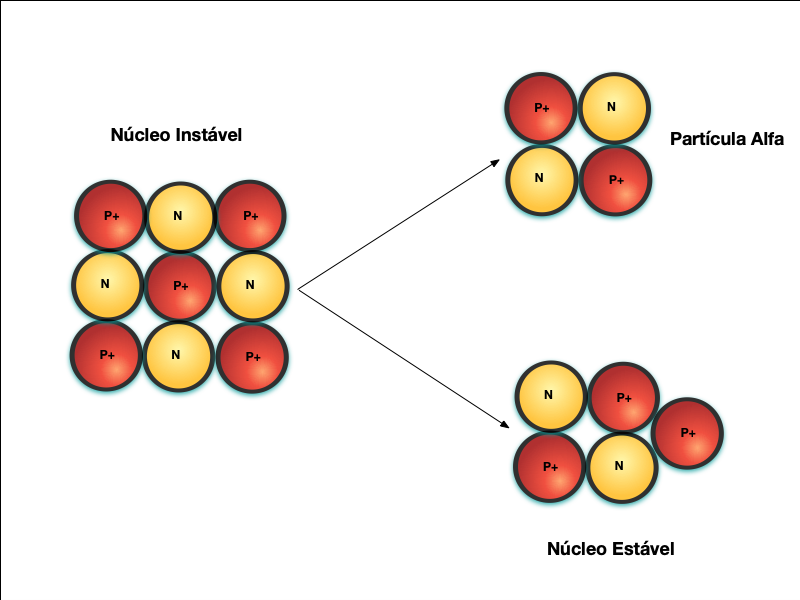
Neste caso, o núcleo original era muito grande e as forças nucleares foram insuficientes para vencer a repulsão eletromagnética. Por isso, este decaimento ocorre apenas em isótopos de massa atômica elevada, normalmente maior que 50.
Parte do núcleo se desprende na forma de partícula alfa e cria-se um elemento com massa atômica menor.
Identificou-se a Partícula Beta resultante de reações nucleares como um Elétron porque sofrem atração da placa positiva do campo elétrico.
A Figura 4 mostra o processo de emissão de partículas Beta, denominado de decaimento Beta.
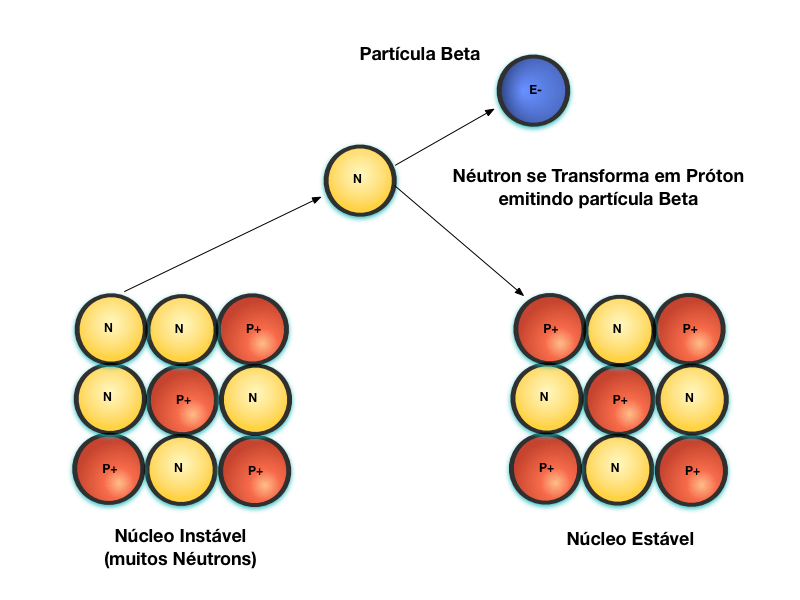
Núcleos instáveis, devido ao número excessivo de nêutrons, se estabilizam através da transformação do nêutron em próton e, em função disso, emite uma partícula Beta para manter o balaço de cargas elétricas.
Por serem mais leves do que as partículas Alfa, as partículas Beta possuem um poder de penetração maior. Contudo, como possuem carga elétrica, a matéria também as absorve rapidamente ou as desvia.
A Figura 5 mostra o decaimento Captura de Elétron. Quando um núcleo se torna instável devido à grande relação de Prótons por Nêutrons, o Próton pode capturar um Elétron e se transformar em Nêutron. Neste caso, como se trata de um processo de captura de um elétron livre, ele não afeta a matéria nas proximidades da reação.
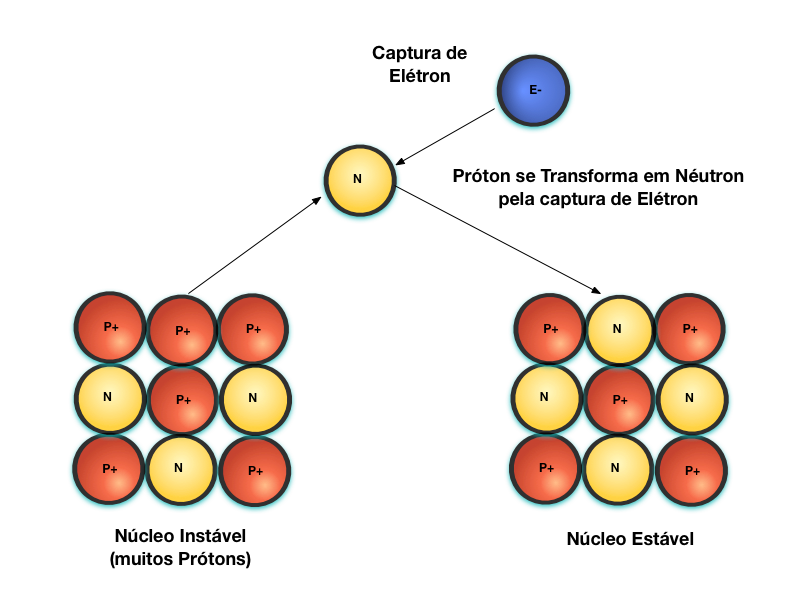
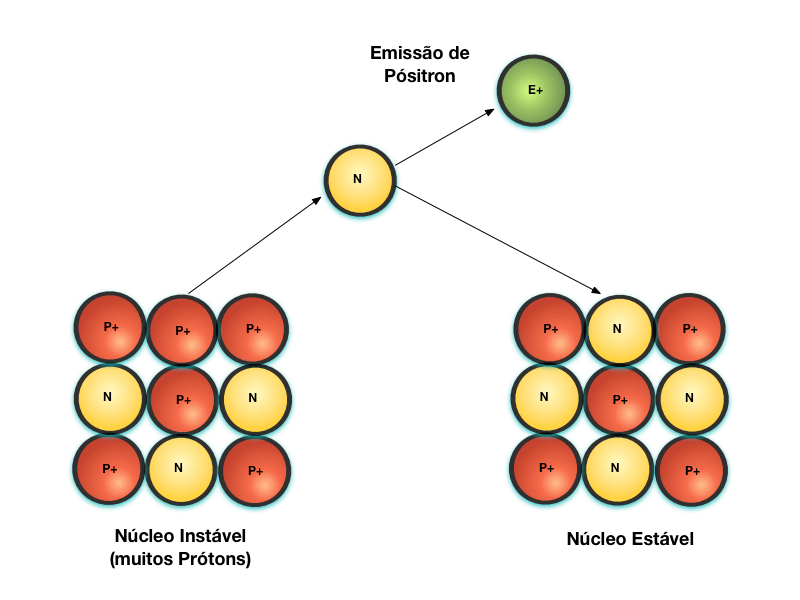
O Decaimento Beta+ consiste noutra forma de transformação do Próton em Nêutron, conforme mostra a Figura 6. Neste caso, o Próton se transforma em Nêutron através da emissão de um Pósitron4, que possui poder de penetração semelhante ao da partícula Beta.
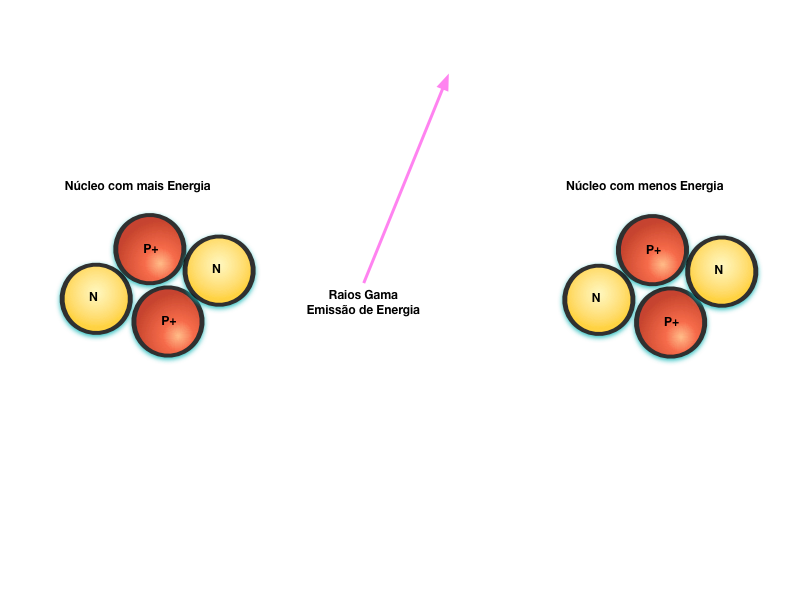
Finalmente, a Figura 7 mostra o decaimento radioativo através da emissão de energia eletromagnética na forma de raios gama. Por se tratar de um Fóton de alta energia, a radiação gama é a mais penetrante e perigosa de todas.
Proteção contra Radiação Nuclear
As três melhores maneiras de se proteger contra a radiação nuclear são:
-
- Tempo
- Distância
- Blindagem
Como os efeitos da radiação nuclear dependem do tempo de exposição, a primeira forma de proteção consiste em minimizar este tempo.
Como a radiação nuclear decai com o quadrado da distância, outra forma de proteção se resume em manter distâncias das fontes emissoras.
Finalmente, como a radiação nuclear que afeta a matéria necessita atingi-la, a blindagem ou escudos funcionam como barreiras de proteção. Por exemplo, por isso utiliza-se coletes de chumbo para a proteção contra raios-X.
Contaminação Radioativa
Classifica-se a contaminação radioativa como:
-
- Externa.
- Interna.
A Contaminação Externa ocorre apenas na superfície externa do corpo e resulta principalmente das formas de radiação eletricamente carregadas – radiação alfa e beta.
Torna-se importante distinguir Contaminação da Radiação nuclear. A Radiação Nuclear consiste na emissão de partículas responsáveis pela radioatividade. Por outro lado, a Contaminação Nuclear ocorre quando qualquer material radioativo entra em contato com a pele ou ingressa no corpo humano.
A lavagem com água e sabão representa a melhor forma de descontaminação externa.
A contaminação interna se torna mais perigosa e ocorre principalmente pelas formas de radiação eletricamente neutras – Raios Gama e Nêutrons, porque a pele não os detém.
Contudo, todas as formas de radiação podem causar contaminação interna se material radioativo for ingerido e/ou absorvido pelos seres vivos através de feridas e/ou mucosas – boca, nariz, olhos etc.
Mediação de Radiação
Os seres humanos não conseguem detectar a radiação nuclear. Por isso, medições indiretas se tornam necessárias.
A unidade de radiação nuclear é o rem (Roentgen Equivalent in Man) que representa a quantidade de radiação necessária para causar determinado tipo de dano no tecido humano.
Outra unidade utilizada na medição da radiação nuclear é o Sievert (Sv), que equivale a 100 rems.
Doses de Radiação
Os efeitos das doses de radiação no corpo humano ainda não são totalmente determinados por falta de dados experimentais.
As bombas atômicas de Hiroshima e Nagasaki propiciaram os primeiros dados práticos para o estudo da radioatividade em seres humanos.
Posteriormente, os acidentes com o Césio em Goiania, Chernobyl e, recentemente, Fukushima forneceram mais dados para aumentarmos nosso conhecimento sobre o efeito da radiação.
Contudo, com o atual conhecimento, doses de radiação superiores a 300 rems causam perda temporária de cabelos e efeitos internos.
Metade das pessoas submetidas até 450 rems morre e a taxa de mortalidade sobe para praticamente 100% com doses superiores a 800 rems.
Energia Atômica
O cálculo da energia envolvida nas reações nucleares se baseia na equação de Einstein.
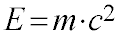
Onde:
-
- E é a energia total do núcleo;
- m é a massa do núcleo;
- c é a velocidade da luz.
No entanto, a massa utilizada nesta expressão precisa levar em consideração a velocidade relativística das partículas de acordo com:
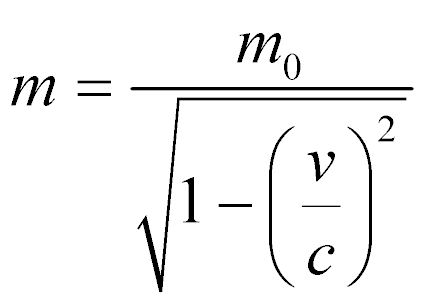
Onde:
-
- m0 é a massa da partícula em repouso;
- v é a velocidade da partícula;
- c é a velocidade da luz.
Para velocidades menores do que a velocidade da luz, pode-se aproximar a energia total por:
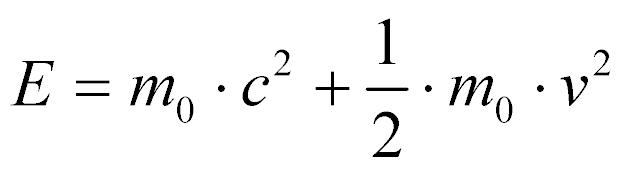
Onde:
-
- mo é a massa em repouso;
- c é a velocidade da luz;
- v é a velocidade da partícula.
Utiliza-se esta aproximação para Nêutrons e nucleons utilizados em reatores nucleares.
A primeira parcela representa a energia em repouso e a segunda a energia cinética.
No caso de partículas sem massa, como os raios gama, utiliza-se a Equação de Planck:
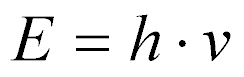
onde:
-
- h é a constante de Planck;
- v é a frequência.
Portanto, pode-se escrever a lei de conservação de energia de uma reação nuclear genérica da seguinte maneira:
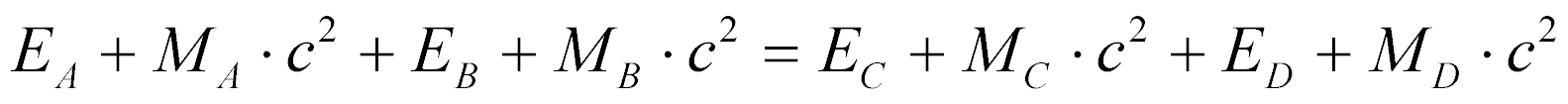
Onde:
-
- Ex é a energia cinética do componente X da reação;
- Mx é a massa em repouso do componente X da reação.
Portanto, a Equação fornece o balanço de energia da reação nuclear.
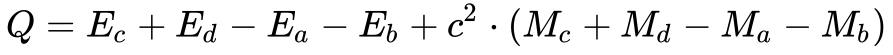
Para valores de Q maiores que zero, considera-se a reação exotérmica e, quando menor do que zero, considera-se endotérmica.
Em reações exotérmicas, massa se transforma em energia, e o oposto ocorre no caso de reações endotérmicas.
Defeito de Massa
Defeito de massa equivale à diferença de massa existente entre determinado átomo e o somatório das massas dos seus elementos, conforme a expressão abaixo:
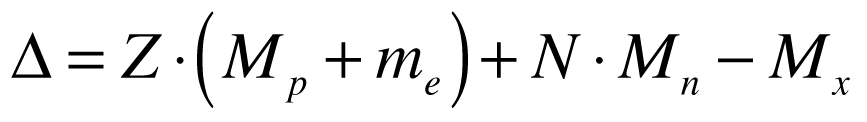
Onde:
-
- Δ é o defeito de massa;
- Z é o número de Prótons no núcleo;
- N é o número de Nêutrons;
- Mp é a massa do Próton;
- me é a massa do Elétron;
- Mn é a massa do Nêutron livre;
- Mx é a massa do núcleo do isótopo.
De acordo com Povh, a massa do núcleo do isótopo pode ser aproximada por:
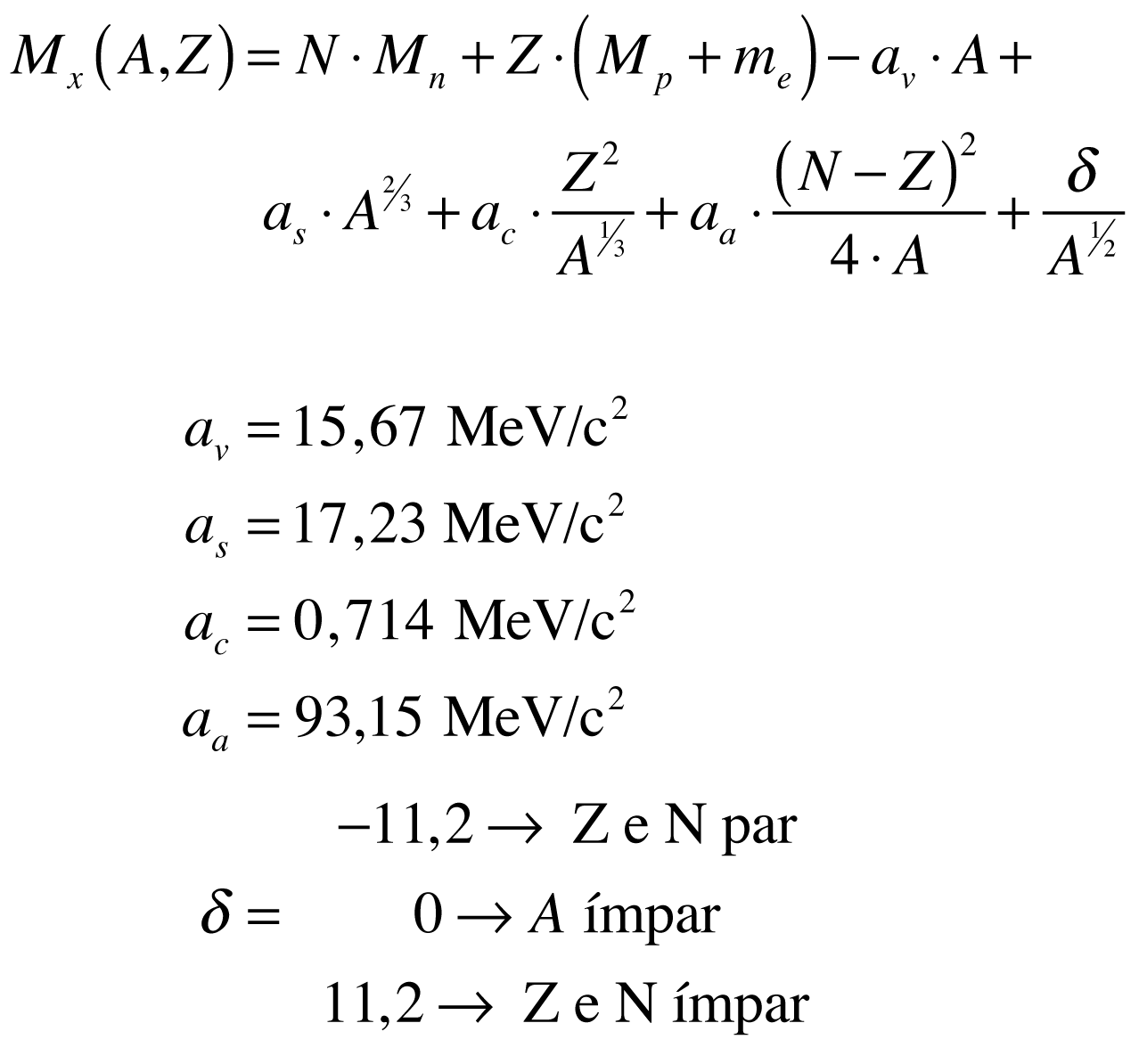
O defeito de massa possui valores positivos para todos os elementos, e multiplicado pela velocidade da luz ao quadrado fornece o valor da Energia de Ligação do núcleo (El=Δ.c²).
Quanto maior for essa energia, maior será a estabilidade do núcleo.
Portanto, a energia de ligação representa a energia necessária para separar totalmente os nucleons de determinado elemento.
A energia de ligação pode ser normalizada pelo número de nucleons da seguinte maneira:
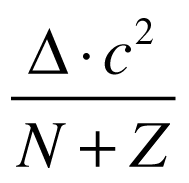
A figura abaixo apresenta a variação da energia de ligação normalizada para diversos nucleons.
Figura 8. Energia de Ligação
Referências
- Beiser, A., Theory and Problems of Applied Physics, 4 ed, 2004, McGraw-Hill.
- Bodansky, D., Nuclear Energy, 2 ed., 2004, Springer-Verlag.
- Lewis, E. E., Fundamentals of Nuclear Reactor Physics, 2008, Elsevier.
- Povh,B., Scholz, C., Rith, K., Zetsche,F., Particules and Nuclei – An Introduction to the Physical Concepts, 4a edição, Springer.
- National Nuclear Data Center