A Eletrólise consiste no processo eletroquímico decorrentes da passagem de corrente elétrica através de substâncias. A eletroquímica fornece a base teórica da eletrólise e se encontra entre a química e a eletricidade. Por isso, engenheiros químicos e elétricos devem estudá-la apesar de ambos se afastarem dela.
Sua importância cresceu nos últimos tempos em decorrência do desenvolvimento tecnológico das baterias, dos veículos elétricos e equipamentos eletrônicos portáteis.

Objetivo
Medir a condutividade da água e de soluções salinas.
Trabalho Preparatório
Assista os seguintes vídeos antes de realizar a experiência.
Materiais
Painéis:
P1.11 Célula
P1.13 Transformador
P1.14 Retificador
Medidores:
Medidores UM1, ohmímetro
Acessórios:
2 Eletrodos de Grafite
Cloreto de amônia
Cloreto de sódio
Água Destilada
Célula
Material de Conexão
Diagrama
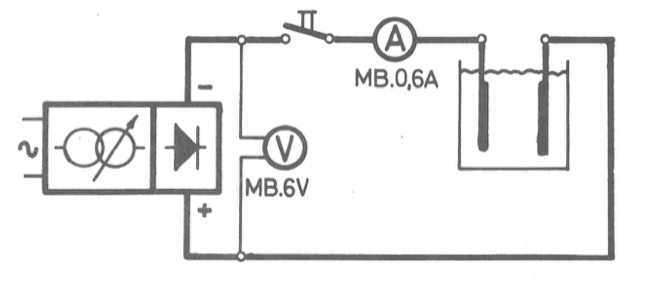
O desenho apresenta um pequeno erro de medição. O voltímetro deve ser conectado nos terminais da célula eletrolítica.
Experiência
-
- Meça com o ohmímetro a resistência entre as suas duas mãos secas.
- Repita a medição com as mãos úmidas (molhadas, mas não pingando).
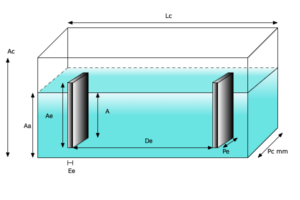
- Meça as dimensões internas da célula (Lc, Ac e Pc).
- Coloque 100 ml de água na célula.
- Meça as dimensões externas dos eletrodos de grafite submersos na água ( Pe, Ae e Ee).
- Meça a distância entre os eletrodos de grafite (De) submersos na água.
- Meça a tensão na célula antes de ligar a fonte de tensão.
- Aumente a tensão aplicada através de 2 eletrodos de grafite, a partir de 0V, até 12V ou corrente de 0,5 A, o que ocorrer primeiro.
- Registre os valores de tensão e corrente na célula.
- Meça a tensão na célula com a fonte desligada e compare com o resultado do item g.
- Adicione 1 g1 de cloreto de sódio na água.
- Aumente a tensão aplicada através de 2 eletrodos de grafite, a partir de 0V, até o desprendimento de gás seja observável.
- Registre os valores de tensão e corrente na célula.
- Adicione mais 1 g de cloreto de sódio e repita as medições.
- Repita a experiência com o cloreto de amônia (NH4Cl).
Apresentação dos Resultados
-
- Faça uma pesquisa sobre o Cloreto de Sódio e o Cloreto de Amônia.
- Calcule a corrente que circularia no corpo submetido à uma tensão de 120 V com as mãos secas e úmidas.
- Compare os valores de corrente encontrados com os valores máximos suportáveis pelos seres humanos.
- Faça tabelas com os valores medidos com o número de casas decimais adequado e indique a precisão.
- Faça o gráfico da corrente em função da tensão medida.
- Faça o gráfico da resistência em função da tensão.
- Calcule a densidade de corrente nos eletrodos e na solução.
- Calcule a condutividade da célula.
- Faça gráfico da condutividade em função da corrente e tensão medidas.
- Faça gráfico da potência em função da corrente e tensão medidas.
Análise dos Resultados
-
- Como a condutividade se comportou com relação à corrente?
- Como a condutividade se comportou com relação à potência?
- Compare os gráficos de condutividade entre sais e entre as concentrações.
- Como a condutividade variou com relação à concentração dos sais?
- Calcule a concentração de cargas elétricas em cada experimento.
- Calcule a mobilidade das cargas em cada experimento.
- Calcule o tempo de relaxação da célula.
- Que outros aspectos foram observados?
Conclusões
Formule hipóteses e modelos para explicar os resultados obtidos.
