Introdução
A combustão é a tecnologia mais antiga da humanidade e é fundamental para o funcionamento de todas as máquinas térmicas utilizadas na geração de energia elétrica.
Ela é um fenômeno complexo de reações químicas que dependem de vários fatores (combustível, mistura ar-combustível, temperatura,etc...) e envolve química, termodinâmica e mecânica dos fluidos.
Para haver combustão é necessário misturar combustível com o comburente, normalmente ar, e queimar a mistura.
A combustão pode ocorrer de dois modos; com chama e sem chama. Por sua vez, a combustão com chama pode ser classificada em pré-misturada ou difusa.
A combustão com chama se caracteriza por se concentrar em uma região no espaço que pode se propagar, ou não.
De um lado dessa fronteira existem os gases quentes resultantes da combustão e de outro existem apenas os gases não queimados. Exemplos deste tipo de combustão são a lamparina e a queima no cilindro de motores de combustão interna com vela de ignição.
A combustão sem chama ocorre quando o processo de combustão ocorre simultaneamente em diversos pontos da mistura combustível comburente. Neste caso, não existe uma região definida que possa ser denominada de chama e o processo é volumétrico. Exemplos deste tipo de combustão são o motor diesel e a detonação em motores motores de combustão interna com vela de ignição, mais conhecida como "bater pino".
Na combustão com chama pré-misturada, o combustível e o comburente são pré-misturados a nível molecular antes de qualquer reação química começar. Exemplo típico deste tipo de combustão é o motor de combustão interna com vela de ignição.
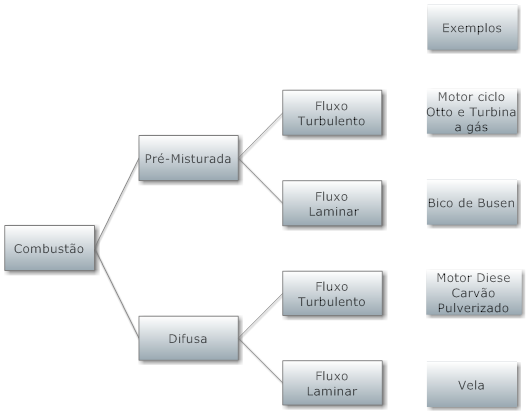
Por outro lado, a chama difusa os reagentes estão inicialmente separados e a combustão ocorre apenas na região onde o combustível se mistura com o comburente. Exemplos de combustão com chama difusa são o motor diesel e a lamparina.
A combustão rápida é a oxidação que produz calor e luz e a combustão lenta é a oxidação que produz apenas calor.
A combustão lenta está associada aos organismos vivos, por isso, não será considerada neste capítulo.
Portanto, a combustão é essencial à vida na terra porque todos os seres vivos a utilizam para respirar e para gerar cerca de 65% da energia elétrica produzida no mundo.
Na maioria dos processos de combustão, o oxigênio necessário é obtido a partir do ar atmosférico. Em base molar, o ar atmosférico é aproximadamente composto por 21% de oxigênio, 78% de nitrogênio e 1% de argônio.
Combustão do Carbono
A combustão do carbono é dada por:
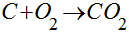
Esta equação significa que 1 mol de carbono ao reagir com 1 mol de oxigênio forma 1 mol de dióxido de carbono liberando energia.
Ela também significa que 12 kg de carbono reagem com 32 kg de oxigênio para gerar 44 kg de dióxido de carbono liberando, de acordo com a Tabela, 109 kWh (9,09 kWh/kg) de energia térmica.
Do ponto de vista ambiental, esta reação gera 3,66 kg de dióxido de carbono por kg de carbono ou 0,403 kgCO2/kWh.
Combustão do Metano
O Metano é o hidrocarboneto mais simples e, quando se queima um hidrocarboneto, tanto o carbono como o hidrogênio são oxidados e se transformam em dióxido de carbono e água. No caso do Metano, a combustão seguirá a seguinte equação:
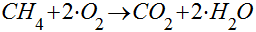
Neste caso, 16,04 kg de metano geram 44 kg de dióxido de carbono. Ou seja, apenas 2,74 kg de dióxido de carbono são gerados por kg de metano. Isto representa 25% menos dióxido de carbono por quilo de combustível se comparado com o carbono.
Do ponto de vista energético, os 16,04 kg de Metano geram 222,6 kWh (13,88 kWh/kg) por kg de combustível, que representa 0,20 kgCO2/kWh. Isto significa que o Metano gera cerca da metade do CO2 gerado pela combustão do carbono. É importante observar que este número não leva em consideração a eficiência das máquinas térmicas.
Combustão de Hidrocarbonetos
No caso da combustão de um hidrocarboneto genérico, teremos que:
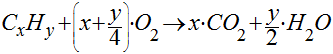
Observa-se que, quanto maior o número de átomos de carbono no hidrocarboneto, maior será a geração de dióxido de carbono.
No entanto, conforme mostra a Tabela, o aumento do número de carbono no hidrocarboneto satura logo o índice de massa de CO2 por massa de combustível queimado e o índice de massa de CO2 por energia térmica liberada.
Desta forma, considerando a emissão do Metano como sendo 100%, a emissão dos hidrocarbonetos é 30% maior e a do carvão é 100% maior do que a emissão de CO2 originada pela queima de Metano.
Os hidrocarbonetos apresentados na Tabela foram escolhidos porque são os elementos que aproximam a composição da gasolina, diesel e óleo combustível.
Combustão de Alcoóis
No caso da combustão de um álcool genérico teremos que:
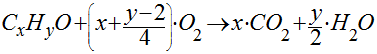
Observa-se que os alcoóis possuem um poder calorífico inferior ao poder calorífico dos hidrocarbonetos - 44% no caso do Metanol e 60% no caso do Etanol.
Por isso, os carros consomem mais álcool - Etanol - do que gasolina por Km rodado e que só vale a pena utilizar o álcool quando o preço do mesmo for inferior a 60% do preço da gasolina.
Por outro lado, vale a pena utilizar o gás natural - Metano - mesmo com preço equivalente à gasolina.
Com relação às emissões de CO2, os alcoóis emitem praticamente a mesma quantidade que os hidrocarbonetos. No entanto, como eles são obtidos a partir da cana de açúcar e do milho, o CO2 emitido é reabsorvido pelo crescimento dos vegetais.
Combustão com Ar
As análises anteriores consideraram a combustão com oxigênio puro.
Apesar desta combustão ser mais eficiente, do ponto de vista energético, na prática, as máquinas térmicas utilizadas na geração de energia utilizam o ar por questões de custo.
O ar é uma composição de gases com predomínio do Nitrogênio (79% vol) e do Oxigênio (21% vol) e pode ser aproximado pela expressão abaixo:

Como o Nitrogênio é um gás inerte, ele não participa do processo de combustão e as equações de combustão passam a ser as expressões abaixo.
No entanto, parte da energia gerada pela combustão é gasta no aquecimento do nitrogênio reduzindo a eficiência do processo.
Por isso, em aplicações especiais, utiliza-se oxigênio no lugar do ar.
Combustão Carbono
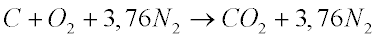
Combustão Metano
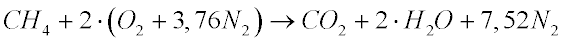
Combustão Hidrocarbonetos
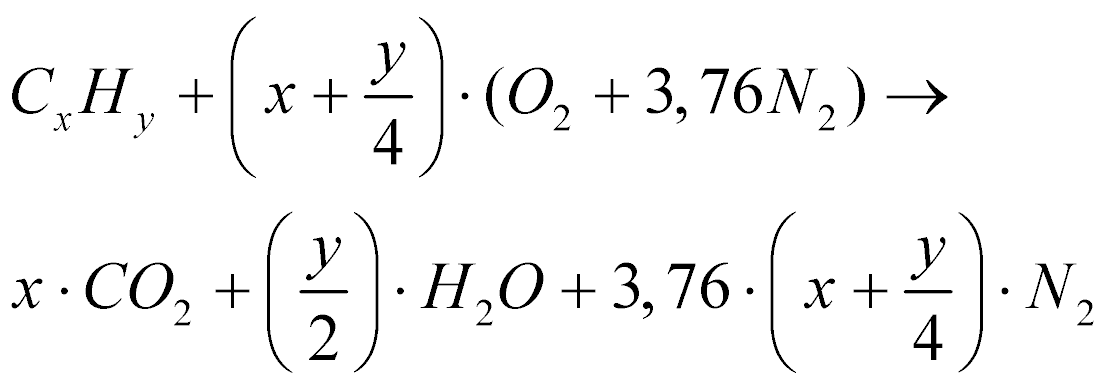
Combustão Alcoóis
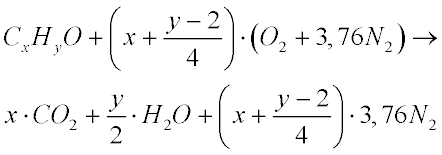
Combustão Estequiométrica
A intensidade da combustão depende da quantidade relativa de combustível e comburente.
A combustão Estequiom�trica é aquela em que a quantidade de combustível e comburente oxidante é tal que todo o combustível é queimado.
As expressões de combustão apresentadas anteriormente são todas estequiométricas.
Nestas condições a eficiência da combustão é máxima e, portanto, deve ser teoricamente o ponto ideal de funcionamento de todas as máquinas térmicas.
Quando a quantidade de comburente é insuficiente para garantir a combustão completa do combustível, dizemos que a mistura é rica.
Por outro lado, se a quantidade de comburente for maior do que a necessária, dizemos que a mistura é pobre.
Para se medir corretamente a concentração de combustível e comburente numa mistura, define-se a relação combustível-oxidante da seguinte maneira:
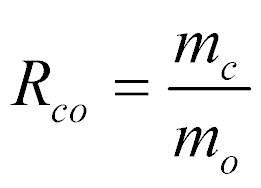
Analogamente, a relação combustível-ar é dada por:
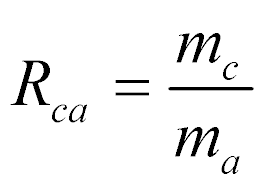
Onde:
- mc é a massa de combustível;
- mo é a massa de oxidante;
- ma é a massa de ar.
Apesar dessas relações serem adimensionais, é conveniente normalizá-las tendo como base a relação estequiométrica.
Desta forma, define-se a relação combustível-comburente normalizada da seguinte maneira:
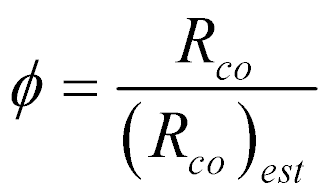
Onde o subescrito est significa a grandeza estequiométrica.
A relação combustível-comburente normalizada varia entre zero e infinito, dependendo da relação combustível-comburente.
A relação combustível-comburente normalizada tende a zero quando a quantidade de combustível, comparada com a quantidade de comburente/ar, tende a zero.
Por outro lado, esta mesma relação tende a infinito quando a quantidade de comburente/ar, comparada com a quantidade de combustível, tende a zero.
A tabela abaixo classifica as misturas de acordo com a relação combustível-comburente normalizada.
Mistura |
||
|---|---|---|
<1 |
Pobre de Combustível |
Pobre |
=1 |
Estequiométrica |
Estequiométrica |
>1 |
Rica de Combustível |
Rica |
A assimetria da relação combustível-comburente normalizada levou alguns autores a utilizar a seguinte definição:
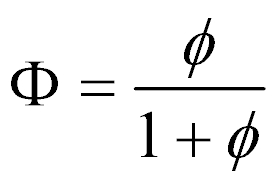
Neste caso, o parâmetro varia entre zero e 1, e as propriedades passam a ser conforme a tabela abaixo.
Mistura |
||
|---|---|---|
<0,5 |
Pobre de Combustível |
Pobre |
=0,5 |
Estequiométrica |
Estequiométrica |
>0,5 |
Rica de Combustível |
Rica |
De acordo com Garcia, a massa de oxigênio necessária para realizar a combustão estequiométrica de determinado combustível é dada por:
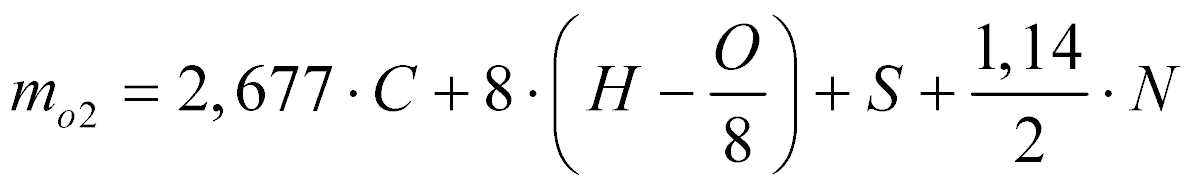
- mo2 é a massa de oxigênio [kg/kg de combustível];
- C é a massa de carbono no combustível [kg/kg de combustível];
- H é a massa de hidrogênio no combustível [kg/kg de combustível];
- O é a massa de oxigênio no combustível [kg/kg de combustível];
- N é a massa de nitrogênio no combustível [kg/kg de combustível];
- S é a massa de enxofre no combustível [kg/kg de combustível];
Também segundo Garcia, o volume de oxigênio necessário para a combustão estequiométrica de determinado combustível é dada por:
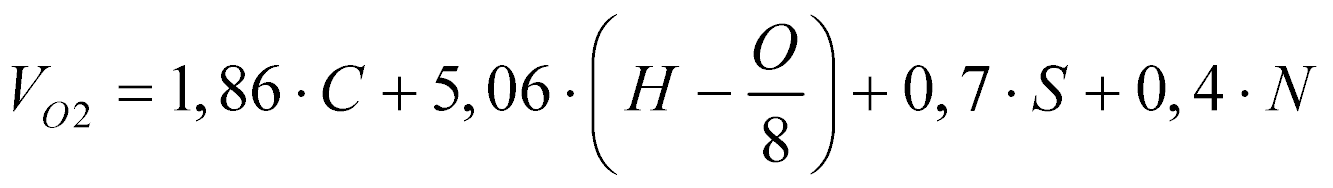
Onde:
- Vo2 é o volume de oxigênio puro [m3 @ 0°C e 0,1MPa]
Considerando o ar como comburente, a massa necessária para realizar a comustão estequiométrica de determinado combustível será dada por:
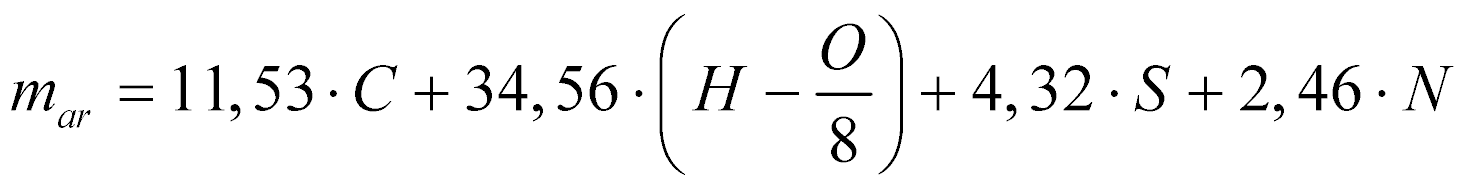
Onde:
m ar é a massa de ar [kg/kg de combustível]
Analogamente, o volume de ar necessário para a combustão estequiométrica de determinado combustível, segundo Garcia, é dado por:
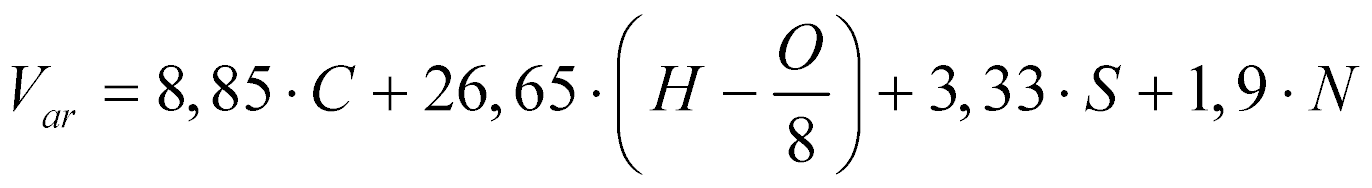
Onde:
- V ar é o volume de ar [m3/kg @ 0°C e 0,1MPa].
Na prática, o consumo de comburente é sempre maior do que o estequiométrico porque as máquinas térmicas devem garantir a queima completa do combustível.
A tabela abaixo mostra que o excesso de ar deve ser maior quando se utiliza combustíveis sólidos do que quando se usa combustíveis gasosos.
| Combustível | Excesso de Ar |
|---|---|
| Gasoso | 0% a 10% |
| Líquido | 0% a 18% |
| Sólido | 12% a 15% |
Teorias da Combustão
As reações apresentadas anteriormente são simplificações de um processo extremamente complexo e difícil de ser estudado.
Dependendo do estado físico do combustível; sólido, líquido ou gasoso, o processo de combustão é diferente porque a dinâmica do ar, em estado gasoso, é diferente.
Além disso, segundo Garcia, existem as seguintes teorias que descrevem a combustão de hidrocarbonetos:
- Teoria da Hidroxilação;
- Teoria dos Radicias Livres;
- Teoria do Craqueamento.

